Publié le 19 juin 2020Lecture 15 min
Dilatation des bronches : questions et réponses pour une vision pratique de la maladie
Philippe SERRIER, Pneumologie et soins intensifs respiratoires, hôpital Cochin, Paris
Depuis quelques années, le diagnostic des dilatations des bronches (DDB) a singulièrement progressé. La banalisation et l’usage très large de la tomodensitométrie (TDM) thoracique en est sans doute en grande partie responsable. Le diagnostic plus fréquent a comme corollaire d’attiser l’intérêt des cliniciens et des chercheurs.
Les données épidémiologiques les plus récentes indiquent que les dilatations des bronches non mucoviscidosiques ont une prévalence de 139 cas/100 000 habitants aux États-Unis en 2013 tous âges confondus. L’incidence et la prévalence augmentent avec l’âge avec une incidence qui double entre la population de 65 à 74 ans et les plus de 75 ans. Quelle que soit la tranche d’âge, il existe une prédominance féminine.
La prise en charge a été sensiblement modifiée ces dernières années. Celle-ci va encore se modifier à l’avenir, grâce aux informations obtenues à partir de la constitution de la cohorte européenne EMBARC qui recueille les données cliniques, microbiologiques, radiologiques, étiologiques et évolutives des patients porteurs de dilatation des bronches non mucoviscidosiques.
Les plus vieux d’entre nous étaient à la fois démunis et fatalistes, habitués qu’ils étaient à prendre en charge des patients rescapés de la tuberculose pulmonaire. Après tout, ils s’en étaient tirés, ils n’avaient pas trop à se plaindre. L’attitude que nous pouvions avoir s’apparentait à « l’aquabonisme mortifère ».
Le diagnostic, c’est la TDM, le traitement c’est beaucoup le drainage bronchique et l’antibiothérapie parmi d’autres. Reste à chercher la cause.
Ce rapide parcours autour des dilatations des bronches a pour but d’éveiller chez chacun de nous l’intérêt d’évoquer le diagnostic et savoir vers quelle prise en charge se diriger. Plus encore, c’est ma vision de l’approche de la maladie que je livre ici, ma « fiche pratique ». Je resterai à distance raisonnable de la mucoviscidose, méritant un sujet à part entière, mais ferai tout pour que vous y pensiez. Le dépistage systématique ne date que de 2002 et n’est pas obligatoire. Il faudra y penser chez les patients nés avant cette date et chez les étrangers. Il y a de fortes chances que ceux que vous verrez soient des formes de découverte à l’âge adulte.
Mais comment faire le diagnostic ?
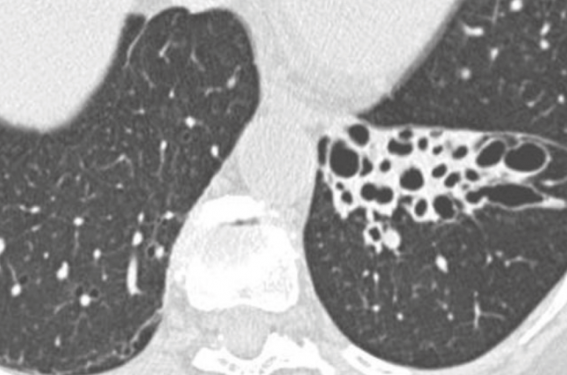
Les dilatations des bronches sont définies par l’imagerie, notamment le scanner (tomodensitométrie haute définition en coupes fines sans injection).
Avant le scanner (et ce n’est pas si vieux)
La clinique orientait le diagnostic, comme aujourd’hui : le ou la patient(e) (mais la dilatation des bronches est plus fréquente chez les femmes) a une bronchorrhée chronique, l’expectoration qui sédimente en deux couches, l’une superficielle muqueuse claire, l’autre, sous-jacente, purulente.
Mettre son nez dessus, c’est repérer l’odeur de « plâtre frais » ou une odeur fétide.
L’imagerie restait réduite à la radiographie de thorax face et profil mais pouvait orienter vers le diagnostic en montrant un épaississement des parois bronchiques, mieux visibles dans les bases, mimant des « rails ».
Et la bronchographie au lipiodol ? Il s’agissait d’utiliser un produit de contraste huileux qui une fois inhalé se collait aux parois bronchiques, mettant en évidence les glandes à mucus hypertrophiées, nombreuses et des bronches dystrophiques.
Si on peut oublier la bronchographie au lipiodol (et ses complications nombreuses…), on n’oubliera pas complètement la radiographie de thorax qui peut nous faire évoquer le diagnostic.
Et aujourd'hui
On définit les dilatations des bronches par une augmentation permanente et irréversible du calibre bronchique dans des territoires pulmonaires plus ou moins étendus. La définition est scanographique selon des critères bien définis, un seul suffit pour affirmer le diagnostic :
diamètre bronchique ≥ 1,5 fois le diamètre artériel (image en « bague à chaton ») ;
absence d’effilement bronchique vers la périphérie, parois bronchiques parallèles sur au moins 2 cm (image en « rail bronchique ») ;
bronches encore visibles à moins de 1 cm de la plèvre.
Mais quelles en sont les causes ?
Interviennent des facteurs infectieux, mécaniques, environnementaux, toxiques et des facteurs liés à l’hôte. Par quels mécanismes ? Il faut retenir le cercle vicieux (dit cercle vicieux de Cole publié dans Thorax en 1985) : agression de la muqueuse – infections favorisées – colonisation bactérienne chronicisée – nouvelles lésions – destruction muqueuse – agression muqueuse – infection, etc.
Les polynucléaires neutrophiles, nombreux dans la lumière et la paroi bronchique, sécrètent des protéases, notamment l’élastase du neutrophile. Ces protéases, dont la sécrétion est entretenue par l’infection chronique, sont à l’origine d’une inflammation chronique des voies aériennes. Les toxines bactériennes aggravent l’agression de la muqueuse. La clairance mucociliaire en est altérée. C’est un des mécanismes de l’augmentation de la sécrétion muqueuse et de l’encombrement bronchique, les cils ne fonctionnant plus normalement.
Les mécanismes d’immunité cellulaire incriminés regroupent l’infiltration de la muqueuse par des lymphocytes CD8, des macrophages, l’interleukine IL-8, le TNF alpha.
Quelles sont les formes de DDB ?
Environ 50 % n’ont pas de cause identifiée, dites idiopathiques, 30 % sont post-infectieuses, 8 à 10 % sont associées à un déficit immunitaire, 7 à 8 % sont associées à une aspergillose bronchopulmonaire allergique (ABPA) et 4 à 5 % sont liées à un reflux gastrooesophagien (RGO), en rappelant la fréquence des RGO, ce qui dilue un peu sa responsabilité.
C’est la conjonction de facteurs environnementaux, surtout infectieux, et d’un terrain prédisposant qui aboutissent à la DDB. On peut les décrire en diffuses ou localisées.
• Les DDB diffuses sont représentées par les maladies immunes, certaines pathologies congénitales dont la mucoviscidose (les lésions prédominant cependant le plus souvent aux lobes supérieurs), la dyskinésie ciliaire primitive. Elles peuvent être séquellaires (rougeole).
• Les DDB localisées sont le plus souvent post-infectieuses ou obstructives. Elles peuvent être dues à une obstruction bronchique ou une compression de la bronche. Si elles sont secondaires à un corps étranger, elles sont alors localisées. Les infections broncho-pulmonaires survenues tôt (ou moins tôt) dans la vie sont des pourvoyeurs classiques. Historiquement, c’est la tuberculose qui était une cause très fréquente de DDB, mais on n’oubliera pas le VRS, la coqueluche, la rougeole, etc. Bref, toute infection sévère ou répétée dans l’enfance peut être la cause de survenue d’une DDB.
Quels sont les facteurs environnementaux ?
• Le principal est l’infection, on l’a vu. Tuberculose surtout, ce qui reste d’actualité, par destruction parenchymateuse, cicatrisation fibreuse, compression de la bronche par une adénopathie.
• Les mycobactérioses non tuberculeuses, dites atypiques : on se souvient du syndrome de Lady Windermere, avec cette DDB du lobe moyen et de la lingula, avec colonisation par Mycobacterium avium, sans doute due autant à un déficit immunitaire qu’aux efforts que déployait la Lady pour ne pas tousser et cracher…
Mais aussi, coqueluche, rougeole, VRS, mycoplasmes, etc. avec une place particulière pour le VIH, la DDB étant plus fréquente chez les sujets infectés par ce virus.
• L’Aspergillus sous la forme d’une ABPA (aspergillose bronchopulmonaire allergique) se caractérise, en principe, par des DDB proximales, des bouchons muqueux composés de mucus riche en polynucléaires neutrophiles et mycélium aspergillaire responsable d’impactions mucoïdes spontanément denses au scanner thoracique) et à une hyperréactivité bronchique provoquée par des réactions allergiques vis-à-vis des antigènes aspergillaires.
• Les facteurs locaux : les corps étrangers intrabronchiques, les compressions bronchiques extrinsèques, certaines tumeurs endobronchiques d’évolution lente, les traumatismes. Il y a parfois alors des solutions chirurgicales.
• L’agression chronique inhalée : on a parlé du RGO. Il ne semble pas y avoir de doute. C’est un co-facteur de DDB, a fortiori lorsqu’il existe une hernie hiatale. Mais l’un comme l’autre étant très fréquents, la responsabilité exclusive du RGO dans la DDB est peut-être exagérée. On en parle plus volontiers dans les DDB des lobes inférieurs. On retiendra aussi les pneumopathies d’inhalation chez les patients, le plus souvent âgés, présentant des troubles de la déglutition.
• La BPCO, modèle d’agression chronique de toxique inhalé.
Et l'hôte dans tout cela ?
Les maladies génétiques ou malformatives
Il y a les raretés : syndrome de Mounier-Kühn, syndrome de Swyer-James, de Marfan, les déficits en alpha-1-antitrypsine dont l’action équilibre celle de l’élastase neutrophilique.
Plus fréquents : les déficits immunitaires, les maladies ciliaires, la mucoviscidose.
Les déficits immunitaires
Il s’agit des hypo- ou agammaglobulinémies, les déficits en une classe d’Ig (A, M ou G), en rappelant la fréquence des déficits en IgA, les déficits en sousclasses d’IgG, surtout en IgG2 et 3, le syndrome des hyper-IgE associant DDB, infections fréquentes, dermatite eczématiforme, syndrome dysmorphique. Ces déficits peuvent parfois être substitués.
La, ou plutôt, les dyskinésies ciliaires primitives (DCP)
`La motilité ciliaire implique 35 protéines codées par au moins autant de gènes qui eux-mêmes peuvent présenter un nombre non négligeable de mutations (par exemple, la mucoviscidose qui est une pathologie monogénique, peut être la conséquence d’une mutation parmi plus de 2 000, etc.). Ceci explique pourquoi l’enquête génétique des DCP est très complexe avec un mode de transmission qui peut varier selon le gène impliqué et qui ne se fait donc pas en routine. Les DCP se présentent le plus souvent avec une historique d’infections ORL récidivantes (otites et sinusites), la présence fréquente d’une polypose naso-sinusienne et la présence de DDB le plus souvent prédominant aux bases. Il existe parfois un situs inversus (syndrome de Kartagener). On trouve souvent une hypofertilité ou une stérilité chez les hommes. Le diagnostic est suspecté devant un tableau clinique compatible et la mesure d’un NO nasal bas, il est ensuite aidé par l’étude des mouvements ciliaires par vidéomicroscopie et l’analyse ciliaire par microscopie électronique à partir d’une biopsie nasale. Cela implique un interlocuteur ORL hautement spécialisé.
Les maladies de système
Au premier rang, on trouve la polyarthrite rhumatoïde (PR). Il existe des anomalies bronchiques dans 1/3 des cas. Les signes cliniques sont relativement peu fréquents, autour de 10 % mais les signes radiologiques en TDM autour de 30 %. Les DDB peuvent précéder les manifestations articulaires de plusieurs années. Les infections sont fréquentes. On retrouve un infiltrat folliculaire lymphoïde, souvent en « manchon » autour des bronchioles, la DDB étant une évolution de la bronchiolite folliculaire. Il existe des analogies antigéniques entre les membranes sy noviales et les membranes bactériennes. On insiste sur le rôle péjoratif du tabac. Quoi qu’il en soit, les DDB sont un facteur péjoratif de l’évolution de la PR.
Les autres : Sjögren, les maladies inflammatoires chroniques de l’intestin, surtout la rectocolite hémorragique, le lupus disséminé, la spondylarthrite ankylosante, la polychondrite atrophiante, la sarcoïdose, la maladie coeliaque, etc.
Mais c’est la PR dont on doit se souvenir au premier chef, tant l’association PR-DDB est fréquente et déterminante dans les choix de traitement et le pronostic.
Mais qui sont ces hôtes que l'on rencontre dans les DDB ?
Les hôtes indésirables bactériens que l’on rencontre fréquemment sont l’Haemophilus inflenzae, le Streptococcus pneumoniae, le Staphylococcus aureus, le Pseudomonas aeruginosa. Dans la mucoviscidose, la colonisation se modifie avec le temps. Chez les jeunes, c’est plus volontiers le S. aureus, et plus le temps passe, plus cette incidence diminue au profit de la colonisation par le Pseudomonas.
Des mycobactéries, M. tuberculosis ou atypiques, surtout M. avium intracellulare.
Parfois le Stenotrophomonasmaltophilia ou l’Achromobacter xylosoxidans. On voit tout le mauvais esprit du Pseudomonas aeruginosa qui sait s’entourer d’une coque d’acide alginique pour résister aux défenses de l’hôte et ne pas simplifier la vie des soignants… De plus, entre autres mécanismes complexes, il stimule la synthèse de sPLA2 (qui est une phospholipase) qui est toxique pour le S. aureus, et c’est une des explications de la modification de la colonisation bactérienne au cours du temps.
Le Pseudomonas est, actuellement, la principale bactérie à grever le pronostic des patients.
Le tableau 1 (BSI) permet d’évaluer la sévérité de la maladie et on y voit le rôle néfaste du Pseudomonas par rapport à d’autres microorganismes colonisants.
Mais que deviennent les patients souffrant de DDB ?
Plus les DDB sont étendues, moins cela va. C’est une maladie surtout féminine, souvent révélée après 50 ans. Les formes localisées s’infectent souvent plusieurs fois par an mais sont le plus souvent améliorées par les traitements antibiotiques.
Le point clé est l’autodrainage bronchique quotidien. Les formes étendues aboutissent le plus souvent à une insuffisance respiratoire par destruction progressive du parenchyme et des alvéoles.
La colonisation par P. aeruginosa est plus souvent tardive et s’accompagne d’un déclin plus rapide de la fonction respiratoire et une dégradation des images scanographiques. La présence de comorbidités associées modifie le pronostic de la maladie (tableau 2 [BACI]).
Mais comment va se présenter cette patiente ?
Elle tousse et crache, quelquefois très abondamment, dès le lever et on retrouve fréquemment ces symptômes dès l’enfance en cas de pathologie congénitale.
Elle crache du sang. L’hémoptysie est fréquente (environ 50 % des cas de DDB), plus ou moins abondante selon l’inflammation muqueuse. Parfois très abondante, elle nécessite une embolisation en urgence en radiologie interventionnelle. Il faut être encore plus vigilant dans les mucoviscidoses. Les biopsies au cours des endoscopies bronchiques sont interdites +++ en raison de la présence d’une vascularisation muqueuse très importante.
La dyspnée est variable, selon l’importance de l’atteinte bronchique, pouvant aboutir à une insuffisance respiratoire chronique grave en cas d’atteinte évoluée.
Il n’y a pas de symptôme spécifique des dilatations des bronches ; en revanche, il faut s’astreindre à rechercher des signes extrarespiratoires qui peuvent orienter vers une étiologie particulière : Raynaud, arthralgies évoquant une PR, signes digestifs évoquant une MICI, etc.
Quels examens doit-on prévoir ?
Une radiographie de thorax face et profil, certes, c’est souvent avec elle que les patients arrivent chez le pneumologue, mais surtout un scanner HD +++.
Un examen cytobactériologique de l’expectoration (ECBC), une fibroscopie bronchique, des EFR, un bilan immun, indispensable +++, une TDM des sinus.
L’imagerie
Le scanner est indispensable au diagnostic mais son analyse fine peut aussi permettre une orientation dans l’enquête étiologique.
On y trouvera les signes radiologiques cardinaux des DDB :
le diamètre de la bronche est supérieur (au moins x1,5) à celui de l’artère pulmonaire adjacente. C’est l’aspect en « bague à chaton » ;
on « suit » les bronches jusqu’au tiers externe du parenchyme pulmonaire, jusqu’à 1 cm de la plèvre ;
la bronche ne « s’effile » pas, son diamètre reste constant sur un long trajet, tout en pouvant être irrégulier ;
on peut trouver aussi des kystes et des impactions mucoïdes.
On peut les décrire en cylindriques, plutôt distales, moniliformes, c’est-à-dire « en forme de collier », plus distales, kystiques, plutôt proximales.
Les impactions mucoïdes sont nombreuses et spontanément denses dans les ABPA. On les met en évidence et c’est alors pathognomonique du diagnostic, en post-traitement MiniP montrant une surbrillance du mucus. Les micronodules bronchiolaires concernant la lingula et le lobe moyen sont évocateurs de mycobactériose atypique (M. avium).
L’atteinte préférentielle des lobes supérieurs évoque une mucoviscidose, alors que l’atteinte des bases plutôt une dyskinésie ciliaire, une pathologie d’inhalation.
L’atteinte trachéale fera penser à une polychondrite atrophiante (mais la clinique l’a souvent précédée).
L’ECBC
Même décrié en raison des risques de contamination oropharyngée, il reste très utile. On le conseille avant toute instauration d’une antibiothérapie et il permet de diagnostiquer une colonisation, notamment par P. aeruginosa. Les critères de qualité requis, à préciser sur la prescription : plus de 25 polynucléaires neutrophiles par champ, moins de 10 cellules épithéliales par champ, prédominance d’un seul germe au direct et d’une flore monomorphe en culture d’au moins 107 bactéries/ml.
La fibroscopie bronchique
Elle a sa place dans l’enquête initiale de DDB localisées. Quelquefois, elles permettent de mettre en évidence un corps étranger, c’est alors une confirmation étiologique immédiate.
Les prélèvements fongiques, bactériens sont faits in situ. Pas de contamination oro-pharyngée. On ne répétera pas assez le risque des biopsies qu’il faut proscrire.
Les explorations fonctionnelles respiratoires
On trouve assez souvent un trouble ventilatoire obstructif. Il est, étymologiquement, inattendu.
La « dilatation » des bronches est, le plus souvent, une « déformation » bronchique, cette déformation induisant des troubles de la turbidité aérienne dans l’arbre bronchique avec des zones de freinage et des zones avec effet Venturi, des zones encombrées de mucus, se traduisant, in fine, par une obstruction aérienne bronchique.
L’encombrement bronchique par un mucus abondant et collant peut générer des atélectasies responsables d’un syndrome restrictif.
Le retentissement de la maladie peut être évalué par un test de marche de 6’.
Ne jamais oublier le test au NO nasal, le test de la sueur, le prendre en compte s’il est intermédiaire (intermédiaire entre 30 et 40. Il est positif à partir de 60), le répéter, la recherche de mutations du gène CFTR.
Le bilan immun est absolument indispensable
Facteurs antinucléaires (FAN), facteur rhumatoïde (FR), anticorps antipeptides citrullinés cyclisés (AC anti CCP), anticorps anticytoplasmes des polynucléaires neutrophiles (ANCA).
Immunoglobulines A, G et M, en se rappelant que les déficits en IgA sont assez fréquents et donc relativement peu significatifs.
Dosage des sous-classes d’IgG (les déficits en IgG2 et 3 sont les plus fréquents)
Bilan aspergillaire (IgE aspergillaires, galactomannane, +- sérologie, d’un moindre intérêt)
IgE totales
Sérologie VIH
Le scanner des sinus de la face
Lorsqu’on recherche : une dyskinésie ciliaire primitive, un foyer dentaire, un foyer sinusien chronique, une aspergillose sinusienne, des anomalies de l’oreille moyenne.
Mieux vaut prévenir que guérir
• Encourager le sevrage tabagique.
• Ne pas négliger les soins dentaires et du nez.
• Proposer les vaccins, antigrippal saisonnier et contre le pneumocoque.
• Interdire l’usage des antitussifs.
Et maintenant que fait-on ?
D’abord drainer
Autokinésithérapie quotidienne, matinale, voire deux fois par jour et kinésithérapie assistée par un kinésithérapeute spécialisé. Conseiller l’exercice physique, surtout chez les réticents à l’autodrainage.
Usage de bêta-2 mimétiques avant le drainage. Logique, facile et sans danger, il faut essayer.
Aérosols de sérum physiologique préalable, pourquoi pas.
Tenter de traiter les primo-infections et l’infection chronique
• En curatif
Après ECBC, selon le germe, on choisit l’antibiotique adapté en évitant la ciprofloxacine en dehors de la mucoviscidose. Si une quinolone est nécessaire, privilégier la moxifloxacine.
Traiter deux semaines.
Si on retrouve un P. aeruginosa, traitement parentéral de 14 jours (ceftazidime- amikacine, par exemple).
Puis colistine en aérosols 3 mois.
Ne pas oublier l’Aspergillus si cela ne guérit pas bien.
• En préventif, pour les patients qui exacerbent plus de deux fois par an.
Si on trouve du Pseudomonas : azithromycine, toujours.
Si c’est inefficace : aérosols de tobramycine ou colistine, continus ou discontinus.
Mais : il n’y a aucune AMM européenne pour les aérosols d’antibiotiques dans les DDB.
Peut-on réduire l’inflammation ?
Éviter les corticoïdes inhalés sauf s’il existe un asthme documenté. Oui avec les macrolides : mais il faut s’être assuré qu’il n’y a pas de mycobactéries en raison du risque d’induction de résistances, que l’espace QT est inférieur à 450 ms, qu’il n’y a pas d’altération des facultés auditives, en se méfiant des interactions médicamenteuses, qu’il n’y a pas d’anomalies du bilan hépatique et que le prérequis sont les fréquentes exacerbations. Tout cela pour prescrire un traitement très souvent efficace mais hors AMM, on le rappelle...
Les doses ne sont pas écrites : 3 x 250 mg d’azithromycine par semaine, voire 2. Toute l’année ou seulement automne-hiver ?
Et que peut-on faire d’autre ?
Opérer les DDB localisées. Mais il faut à la fois économiser le poumon restant tout en évitant sa destruction par colonisation par voisinage.
Emboliser les artères bronchiques en cas d’hémoptysie, même en primo-intention après angioscanner des artères bronchiques pour cartographie.
Proposer une réhabilitation en centre spécialisé. Très efficace. Améliore la qualité de vie.
Ventiler dans les formes avancées.
Penser à la greffe lorsque l’espérance de vie sans greffe est inférieure à celle espérée après greffe (concerne les patients avant 65 ans essentiellement). Le bilan prétransplantation peut être anticipé, avant de l’envisager et, aussi, pour éliminer les contreindications à la greffe et ne pas briser un espoir si la greffe est irréaliste ou impossible.
Et quand penser à la mucoviscidose ?
Si elle n’a pas été détectée en néonatal, y penser devant des DDB prédominant aux lobes supérieurs, des images diffuses au scanner, des troubles digestifs associés, un asthme corticodépendant, une ABPA. Le couple ABPA-DDB doit faire rechercher une mucoviscidose.
Il est facile et peu coûteux de faire un test de la sueur dans les centres spécialisés qui sera répété à deux reprises a fortiori si le résultat est « intermédiaire ».
Confier, dans le doute, ou devant un test de la sueur positif, le patient à un centre spécialisé afin d’effectuer une recherche de mutations du gène CFTR et avoir le conseil d’un centre de référence.
De plus, l’inscription des patients diagnostiqués DDB dans le registre EMBARC améliorerait la connaissance de la maladie.
Au total, les DDB, il faut :
• Y penser.
• Être rigoureux dans l’enquête clinique et paraclinique.
• Documenter la bactériologie. • Aider les malades (kinésithérapie, réhabilitation, écoute, disponibilité).
• Partager la prise en charge avec les centres de référence.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :