Cancérologie
Publié le 18 jan 2018Lecture 8 min
Actualité de la prise en charge du mésothéliome
Solenn BROSSEAU(1,2), Charles NALTET(1), Valérie GOUNANT(1,2), Gérard ZALCMAN(1,2) - 1. Service d’oncologie thoracique, Hôpital Bichat-Claude Bernard, Université Paris-Diderot, Paris ; 2. Intergroupe francophone de cancérologie thoracique (IFCT), Paris
Le mésothéliome pleural malin (MPM) est une tumeur rare (1 000 cas annuels en France), encore incurable, qui résulte de l’utilisation industrielle de l’amiante, sans protection des salariés des industries de transformation ou ceux du bâtiment, exposés ainsi à leur insu à l’inhalation de ces fibres, pendant la plus grande partie du XXe siècle. Très rare dans la population générale non exposée à l’amiante (< 1 cas/million d’habitants et par an), le MPM représente 100 cas/million/an dans la population exposée. Certaines régions telles que la Normandie, le Nord, les Bouches-du-Rhône, la Loire-Atlantique ont une incidence élevée de 30 nouveaux cas ou plus par an, du fait de l’existence d’industries de transformation de l’amiante, de fonderies ou de chantiers navals dans ces régions(1).
Seuls 2 à 5 % des sujets exposés professionnellement seront atteints de mésothéliome, avec un temps de latence de 20 à 40 ans, la fraction attribuable (le nombre de cas directement liés) à une exposition professionnelle à l’amiante étant estimée à 83 % chez les hommes, mais seulement de 38 % chez les femmes, qui pourraient avoir des expositions indirectes(2). L’incidence du mésothéliome pleural n’a cessé de croître depuis une quarantaine d’années, le plateau pouvant avoir été atteint chez les hommes, mais pas encore chez les femmes(1). Le mésothéliome pleural est reconnu au titre des maladies professionnelles, au tableau 30 du régime général de la Sécurité sociale et 47 du régime agricole, constituant depuis le décret de janvier 2012, la 31e maladie à déclaration obligatoire.
Diagnostic histologique du mésothéliome pleural
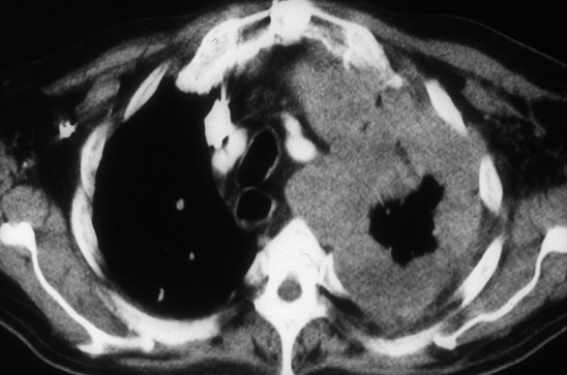
La cellule mésothéliale transformée peut mimer des cellules d’aspects très différents, de la cellule épithéliale à la cellule sarcomateuse. Quatre-vingt à 85 % des mésothéliomes sont dits « épithélioïdes », 11 % sont dits « sarcomatoïdes » et 5 à 10 % sont mixtes, avec les deux composantes, le pronostic étant lié à l’importance de la composante sarcomatoïde. L’analyse du liquide pleural est insuffisante pour le diagnostic de certitude du MPM, la sensibilité de la cytologie pleurale n’étant que de 60 %(3). Les biopsies pleurales à l’aiguille posent les mêmes problèmes diagnostiques que la cytologie. Seule l’analyse anatomo-pathologique de prélèvements de taille suffisante, au mieux obtenus par pleuroscopie, conseillée en première intention, après une analyse immunohistochimique utilisant au moins 5 marqueurs différents, permet de distinguer un mésothéliome malin de lésions pleurales bénignes, inflammatoires ou réactionnelles, ou de métastases pleurales d’adénocarcinome pulmonaire ou mammaire, constituant les diagnostics différentiels les plus fréquents du mésothéliome de type épithélioïde (figure 1)(4). Le diagnostic de MPM nécessite par ailleurs une validation obligatoire par le centre national pathologique de référence, MESOPATH.
Figure 1. Mésothéliome pleural gauche.
Pris en charge thérapeutique
La radiothérapie des orifices de ponction, biopsie et thoracoscopie
Le mésothéliome à la particularité d’envahir et coloniser les trajets de ponction pleurale, drainage ou pleuroscopie avec une fréquence de 10 % dans toutes les séries de la littérature (figure 2)(5), mais jusqu’à 20 % pour les cicatrices de gros drains ou chirurgicales. Ces métastases de réperméation sont rapidement douloureuses et peuvent diffuser dans la paroi et les parties molles, rendant leur traitement palliatif inefficace, même avec une irradiation à visée antalgique. Un essai français avait permis de codifier un traitement préventif consistant à irradier préventivement ces trajets de ponction, dans les 21 jours postponction, à 7 Gy sur 3 jours consécutifs (21 Gy au total), avec des électrons de haute énergie et un boost cutané adapté à la profondeur de l’infiltration(6). Cette pratique est toujours recommandée en France alors qu’elle fait l’objet d’un scepticisme anglo-saxon du fait de la petite taille de l’essai princeps (40 patients). Un essai britannique randomisé récent chez 203 patients a montré que la radiothérapie dans les 42 jours postdrainage ou chirurgie, diminuait l’incidence de ces métastases de près de moitié, de 16 à 8,8 % (p = 0,14), et de 16 à 6 % (p = 0,037), lorsque les délais et les modalités techniques de la radiothérapie étaient respectés, confortant l’efficacité de cette procédure(7).
Figure 2. Mésothéliome : aspect en pleuroscopie, permettant de larges biopsies.
La chirurgie
La chirurgie radicale par pleuropneumonectomie extra-pleurale élargie (PPE), c’est-à-dire une résection complète en monobloc du bloc pleuro-pulmonaire, élargie au péricarde fibreux et au diaphragme, complétée par une irradiation hémi-thoracique, a été abandonnée par la plupart des équipes. De fait, l’essai de phase 2 de l’EORTC(8), puis l’essai britannique MARS(9), n’ont pas montré l’intérêt de la PPE, la survie globale dans ces essais restant modeste (autour de 15 mois), au regard d’une morbi/mortalité postopératoire à 90 jours trop lourde, excédant 12 %. Les équipes chirurgicales entraînées se retournent désormais vers une pleurectomiedécortication, très mal codifiée techniquement, à titre de « cytoréduction », pour les formes les plus précoces, chez des patients très sélectionnés, suivie ou précédée d’une chimiothérapie.
La chimiothérapie
C’est l’association d’un antimétabolite et d’un sel de platine qui apporte une amélioration décisive, le doublet de cisplatine et pémétrexed se montrant significativement plus efficace qu’une monochimiothérapie par cisplatine seul(10). Le temps jusqu’à progression était de 5,7 mois avec ce doublet dans l’essai randomisé princeps de phase 3(10). Dans cet essai, chez des patients dont l’état géné- ral était conservé (Karnosky > 70 %, index OMS < 2), la survie à un 1 an du groupe ayant reçu le doublet de chimiothérapie avec une supplémentation vitaminique était de 56,5 %, contre 41,9 % aux patients traités par le seul cisplatine, la médiane de survie étant de 13,3 mois contre 10 mois dans le groupe cisplatine seul. Cependant, la survie à 5 ans reste virtuellement nulle. Le doublet pémétrexed plus cisplatine a démontré qu’il pouvait améliorer la qualité de vie et les symptômes chez ces patients, et cette association est donc recommandée en première ligne, en arrê tant la chimiothérapie en cas de progression ou de toxicité, ou, en cas de contrôle tumoral après 6 cures(11).
Les arguments de la littérature, bien que ténus, plaident pour débuter la chimiothérapie dès l’obtention du diagnostic, sans attendre une évolution symptomatique(12). Faute d’’essai contrôlé, la maintenance par monothérapie de pémétrexed n’est pas recommandée, contrairement au cancer bronchique, ce d’autant que le re-traitement par pémétrexed en cas de récidive reste le plus souvent efficace(13). Plusieurs essais de phase 2 ont montré l’efficacité comparable de l’association pémétrexed /carboplatine en cas d’altération modérée de l’état général ou de la fonction rénale(14). Il n’y a toujours pas de chimiothérapie standard qui puisse être recommandée en deuxième ligne après échec d’une première ligne à base de cisplatine.
Les thérapeutiques innovantes
Le vascular endothelial growth factor (VEGF), est un puissant mitogène pour les cellules mésothéliales comme endothéliales. Les mésothéliomes malins peuvent en effet secréter du VEGF alors qu’elles expriment ses deux principaux récepteurs, Flt-1 et KDR. Le VEGF est capable, en activant ses récepteurs, d’induire la croissance autocrine des cellules de mésothéliome(15). L’Intergroupe francophone de cancérologie thoracique (IFCT) avait présenté en 2015 les résultats de l’essai multicentrique de phase 3 MAPS, randomisant le doublet pémétrexed-cisplatine au même doublet associé au bévacizumab (Avastin®), un anticorps ciblant le VEGF, chez des patients avec mésothéliome pleural, à l’état général conservé (figure 3).
Figure 3. Résultats de l’étude MAPS randomisant le doublet pémétrexed-cisplatine (en bleu) au même doublet associé au bécacizumab (en rouge).
Cet essai était positif avec une médiane de survie globale de près de 19 mois dans le bras Avastin®, contre 16 mois dans bras pémétrexed-cisplatine, et une survie sans progression significativement allongée (p < 0,0001)(16). Les premières données d’essais cliniques concernant l’usage, en deuxième ligne de traitement, après pémétrexed et sel de platine, d’inhibiteurs des points de contrôle immunologiques, à savoir des anticorps monoclonaux dirigés contre les antigènes CTLA-4, PD-1 ou PDL-1 se sont avérés prometteurs.
Conceptuellement, cibler les antigènes inhibiteurs de la réponse tumorale semble pertinent car les mésothéliomes, qui sont souvent des tumeurs très inflammatoires, avec un stroma abondant, expriment fortement ces antigènes et cette surexpression est un facteur de mauvais pronostic(17). Le pembrolizumab (MK3475, MSD), un anticorps monoclonal anti-PD-1 a été évalué comme malin (MPM) dans l’essai de phase Ib Keynote 028 ayant inclus des patients présentant diverses tumeurs solides(18). Quatre-vingt-quatre patients ayant un MPM ont été screenés pour PD-L1 ; 38 (45 %) exprimaient PD-L1, la cible de PD-1, dans au moins 1 % des cellules. Les 25 patients éligibles dans l’essai, prétraités et échappant à la chimiothérapie classique, ont été traités par du pembrolizumab toutes les 2 semaines jusqu’à progression ou toxicité inacceptable. Le taux de réponse était de 28 % et le taux de contrôle de la maladie de 76 %. La durée de réponse semble prolongée de 10,4 à plus de 40 mois, et la médiane de survie n’était pas atteinte lors de la présentation des résultats. La médiane de survie sans progression n’était cependant que de 5,8 mois. L’IFCT vient de terminer les inclusions dans l’essai MAPS-2, chez des patients progressifs, prétraités par sel de platine et pémétrexed, en bon état général. Cet essai a évalué en deuxième ligne thérapeutique, le nivolumab, anticorps anti-PD-1 (Optivo®, BMS), et d’autre part l’association nivolumab-ipilimumab (Yervoy®, BMS), anticorps ciblant une autre molécule inhibant la réponse immunitaire antitumorale le CTLA-4. Cette association semble synergique avec des résultats particulièrement intéressants dans le mélanome. Ainsi, 125 patients ont été inclus dans MAPS2 en moins de 5 mois, et les résultats seront présentés eu cours de l’année 2017.
Conclusion
Le mésothéliome malin pleural était une maladie presque orpheline du fait de son pronostic sombre et de la rareté des thérapeutiques efficaces disponibles. Le grand tournant thérapeutique a été l’introduction au début des années 2000, du pémétrexed, qui en association aux sels de platine a changé l’histoire naturelle de cette maladie. La chirurgie de cytoréduction tumorale (pleurectomie-décortication), est réservée à des patients très sélectionnés, à relativement faible masse tumorale. L’ajout du bévacizumab à la chimiothérapie par pémétrexed et sel de platine constitue une avancée certaine de par son impact sur la survie sans progression et la survie globale, démontrée par le plus grand essai thérapeutique depuis 10 ans dans le mésothéliome, l’essai français MAPS de l’IFCT, et constitue le nouveau standard thérapeutique, en attendant, peut-être, les résultats dans les années à venir des essais de traitements ciblant les points de contrôle immunologiques.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :