Publié le 14 fév 2017Lecture 10 min
Découverte de kystes pulmonaires au scanner : orientations diagnostiques
E. REYMOND, secteur Imagerie thoracique, radiologie centrale, CHU de Grenoble
Difficilement visibles en radiographie standard, les kystes pulmonaires sont souvent de découverte fortuite au scanner. En pratique, comment les reconnaître et quelle démarche diagnostique envisagée ?
Qu’est-ce qu’un kyste pulmonaire ?
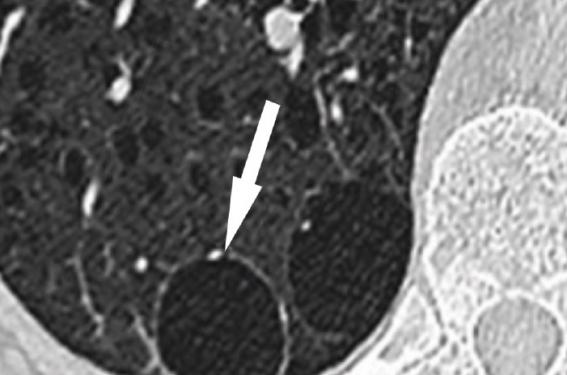
La Fleischner Society propose une définition précise : il s’agit d’une image ronde, hypodense, avec une interface nette par rapport au parenchyme adjacent (correspondant en histologie à un épithélium ou une paroi fibreuse). L’épaisseur de la paroi est variable mais habituellement fine (< 2 mm). Le contenu est le plus souvent aérique, mais peut être également liquide ou solide(1) (figure 1 A). La première étape devant une telle image est de s’assurer qu’il s’agit bien d’un kyste (figure 1). Les images trompeuses sont nombreuses.
Parmi les diagnostics différentiels, il faut évoquer :
• l’emphysème, qui correspond à une plage focale hypodense, sans paroi visible. La distinction avec un kyste est parfois difficile, notamment chez les patients tabagiques(1). Pour les distinguer, on peut s’aider de deux critères :
– l’absence de paroi propre dans l’emphysème, puisqu’il s’agit d’une distension des espaces aériens distaux. Ce signe est parfois douteux : la « pseudo paroi » autour de la bulle d‘emphysème correspond simplement au parenchyme pulmonaire adjacent condensé,
– la visualisation d’un point au centre de l’image aérique « dot-like structure » qui oriente vers l’emphysème, puisqu’il correspond anatomiquement à l’artère centrolobulaire, au sein du lobule secondaire distendu (figure 1 B), alors que dans un kyste, l’artère est périphérique (figure 1 A) ;
• les dilatations de bronches kystiques : le diagnostic est facilement corrigé grâce aux reformations multiplanaires, montrant la communication de l’image aérique avec l’arbre bronchique (figure 1 C et D) ;
• les pneumatocèles qui correspondent à des images aériques pulmonaires arrondies à paroi fines(1), survenant dans un contexte de traumatisme ou d’infection. Ces images sont le plus souvent régressives ;
• le « rayon de miel » qui correspond à des kystes accolés, de diamètre similaire (3 à 10 mm, parfois jusqu’à 25 mm), avec des parois bien limitées. L’atteinte est sous-pleurale et mime l’aspect des « nids d’abeilles »(1). Ce terme sous-entend une pathologie pulmonaire au stade terminal, il est une des caractéristiques de la fibrose pulmonaire (figure 1 E) ;
• Les cavités qui sont des espaces aériques au sein d’une condensation ou d’une masse(1). Elles se différencient des kystes par leur paroi épaisse, en général > 4 mm(2). Les étiologies des cavités sont les néoplasies (carcinome épidermoïde pulmonaire, lymphome, mélanome), les emboles septiques, les infections fongiques et à mycobactéries (figure 1 F), les vascularites (maladie de Wegener)(2).
Figure 1 A. Kyste pulmonaire typique, arrondi, à parois fines, avec une artère périphérique (flèche blanche).
B : plusieurs bulles d’emphysème centrolobulaire, sans paroi identifiable avec, au centre de chacune des bulles,une artère visible (flèche blanche).
C et D : pseudo images kystiques en coupe axiale (C), correspondant à des dilatations des bronches plus faciles à identifier sur la reformation sagittale (D).
E : images de « rayon de miel » typique des bases pulmonaires dans le cadre d’une fibrose pulmonaire de type pneumonie infiltrante commune (PIC).
F : image de cavité à paroi épaisse et irrégulière du segment ventral du culmen, avec un petit niveau liquidien,
correspondant à un abcès pulmonaire à Candida, en cours de détersion sous traitement antifongique.
Quelles orientations diagnostiques devant la découverte d’un kyste pulmonaire ?
Une classification des maladies pulmonaires avec des kystes diffus a été proposée par N. Gupta et coll.(3), les principales étiologies sont résumées dans le tableau. À suivre quelques tableaux scannographiques évocateurs chez l’adulte.
Lymphangioléiomyomatose (LAM)
Il s’agit d’une pathologie pulmonaire rare, qui survient de manière sporadique (prévalence: 1 femme/ 400 000) ou associée à une maladie génétique autosomique dominante: la sclérose tubéreuse de Bourneville(4)(figures 2 et 3). La forme sporadique atteint quasi exclusivement les femmes, en période d’activité génitale(5), avec un âge médian de découverte entre 35 et 40 ans. Les formes de découverte tardive post-ménopausiques sont aussi possibles et représentent 10 % des cas. L’atteinte des hommes et des enfants est exceptionnelle(6).
Dans le cadre de la sclérose tubéreuse de Bourneville, la LAM est présente dans 30 à 50 % des cas. Les hommes sont aussi atteints mais de manière moins fréquente et moins sévère que les femmes(7,8). Cette pathologie est caractérisée par une prolifération anormale des cellules musculaires lisses immatures et de cellules épithélioïdes périvasculaires entraînant la formation de kystes pulmonaires, de masses lymphatiques abdominales ou pelviennes (lymphangioléiomyomes) et de tumeurs rénales bénignes, les angiomy lipomes. Au niveau pulmonaire, la prolifération cellulaire entraîne une obstruction bronchiolaire et la destruction kystique du parenchyme pulmonaire(9). Les signes cliniques sont une dyspnée, des douleurs thoraciques des pneumothorax récurrents, des épanchements pleuraux chyleux et des hémoptysies(10).
Figure 2. Patiente de 47 ans suivie pour une LAM.
A : scanner thoracique, reconstruction coronale montrant de multiples kystes atteignant le parenchyme pulmonaire de manière diffuse.
B : reformation coronale avec un nodule rénal droit de densité graisseuse (- 83 UH) correspondant à un angiomyolipome.
C : reformation sagittale : formation kystique rétropéritonéale, en rapport avec un lymphangio-léiomyome.
Figure 3. Patiente de 24 ans suivie pour une sclérose tubéreuse de Bourneville.
A et B : scanner thoracique, reformation coronale (A) et coronale en MinMIP (B), montrant l’atteinte kystique diffuse et quelques nodules.
C : scanner abdominal présentant de multiples angiomyolipomes du rein droit.
Au scanner, on retrouve des kystes, le plus souvent ronds, distribués classiquement de manière homogène dans tout le parenchyme pulmonaire(4). Une étude retrouve une atteinte préférentielle des apex et du poumon moyen, avec une épargne relative des bases et des zones périphériques(11). Leur taille varie: le plus souvent entre 2 et 5 mm de diamètre, parfois jusqu’à 30 mm(12). La paroi des kystes est le plus souvent < 2 mm mais a été décrite jusqu’à 4 mm(4). Dans un tableau typique, les kystes sont multiples (> 10). Toutefois, le diagnostic reste possible s’ils sont moins nombreux (entre 2 et 10)(4). Le reste du parenchyme pulmonaire est normal, sauf dans quelques cas de sclérose tubéreuse de Bourneville, où il peut exister une atteinte micronodulaire multifocale, liée à une hyperplasie des pneumocytes(4,13). Un scanner abdominal complémentaire est recommandé lorsque le diagnostic de LAM est suspecté, à la recherche d’angiomyolipomes rénaux (présents dans 100 % des cas de sclérose tubéreuse de Bourneville, 50 % des LAM sporadiques) et de lymphangioléyomyomes(4) dans 10 % des cas. Le diagnostic de certitude a été établi en 2010 par la European Respiratory Society(4). La biopsie chirurgicale pulmonaire n’est plus forcément nécessaire. Un scanner pulmonaire caractéristique et un des items suivants : angiomyolipome rénal, lymphangioléiomyome, épanchement chyleux thoracique ou abdominal, adénomégalie atteinte par la LAM, sclérose tubéreuse certaine ou probable, permettent de poser le diagnostic.
Histiocytose langerhansienne pulmonaire (PLHC)
Cette pathologie correspond à la prolifération d’histiocytes spécifiques, les cellules de Langerhans(14), au sein des petites voies aériennes distales(15) (figure 4). L’atteinte pulmonaire isolée est rencontrée quasiment exclusivement chez les fumeurs (90 % des cas)(16). La maladie survient chez des patients âgés de 30 à 40 ans, révélée le plus souvent par une toux et une dyspnée(15). Dans quelques cas, les patients présentent de la fièvre, des douleurs thoraciques et des hémoptysies, mais le plus souvent les symptômes sont légers et non spécifiques. Un contexte de pneumothorax récidivant est fréquent(17). Les signes cliniques et radiologiques sont le plus souvent améliorés après l’arrêt du tabac(18).
L’aspect scannographique varie selon le stade de la maladie. À la phase initiale, on retrouve des micronodules ou des nodules (de 1 à 10 mm) de distribution centro-lobulaire, mal limités, parfois isolés à la phase débutante bien que l’association à des kystes soit typique. Dans un second temps, les nodules ont tendance à la cavitation et des kystes vont apparaître(19). Les kystes sont le plus souvent ronds, < 10 mm, à paroi régulière. Ils ont tendance à la confluence, entraînant des formes bizarres, bilobées, en feuille de trèfle ou d’aspect branché(14,19-21). La distribution des kystes montre une atteinte préférentielle des régions supérieure et moyenne, avec une épargne relative des bases et des régions sous-pleurales(22). Le scanner permet un diagnostic correct de PLHC dans 74% des cas, et surseoirait la biopsie pulmonaire chirurgicale dans les cas les plus typiques(23).
Figure 4. A : histiocytose langerhansienne pulmonaire avec nodules troués et kystes.
B et C : histiocytose langerhansienne pulmonaire avec multiples kystes confluents, la reformation coronale (C) montre l’épargne relative des bases.
Syndrome de Birt-Hogg-Dubé (BHD)
Il s’agit d’une maladie autosomique dominante, associant des kystes pulmonaires dans 89 % des cas(24), des tumeurs rénales bilatérales et multiples chez la moitié des patients, et des lésions cutanées du visage et du torse (fibrofolliculomes, trichodiscomes) (figure 5). La maladie est souvent découverte à la 4e ou 5e décade, mais peut se révéler chez des adolescents ou des octogénaires(25).
L’atteinte pulmonaire est le plus souvent asymptomatique ou entraîne des pneumothorax à répétition(26). Un homme jeune avec une histoire familiale de pneumothorax et des lésions cutanées doit faire évoquer le diagnostic(25). Les kystes pulmonaires sont multiples, de taille variable, ronds, ovalaires ou irréguliers. Ils prédominent dans les régions inférieures, surtout centrales.
Dans tous les cas, certains des kystes sont contigus ou engainent la partie proximale des artères ou des veines pulmonaires(24). Une histoire familiale évocatrice et une enquête génétique sont les deux éléments qui permettent de différencier cette pathologie des autres atteintes pulmonaires avec des kystes diffus(26).
Figure 5. Kystes des bases pulmonaires, ovalaires ; certains autour de structures vasculaires et tumeur rénale chez un
patient de 50 ans suivi pour une maladie de Birt-Hogg-Dubé.
Atteintes infectieuses
La pneumocystose, infection à Pneumocystis jirovecii, est un tableau à connaître parmi les atteintes infectieuses. Il s’agit du mode de révélation fréquent d’un sida/VIH. Le scanner retrouve une atteinte bilatérale en dépoli, avec réticulations et kystes associés (figure 6). Les kystes, dont la taille et l’épaisseur de paroi sont variables, sont plus fréquents chez les patients immunodéprimés (56 % versus 3 % des cas)(27), disséminés de manière diffuse ou au niveau des lobes supérieurs.
Figure 6. Pneumonie à Pneumocystis jirovecii chez un patient séropositif au VIH.
Le scanner retrouve un infiltrat en verre dépoli associé à des kystes.
Maladies kystiques pulmonaires et anomalies lymphoprolifératives
La LIP (Lymphocytic Interstitial Pneumonia) et la bronchiolite folliculaire correspondent à une infiltration par du tissu lymphoïde polyclonal des voies aériennes et des espaces interstitiels. Le plus souvent cette atteinte est associée à des pathologies auto-immunes: syndrome de Sjörgen (figure 7) mais aussi polyarthrite rhumatoïde, lupus systémique érythémateux. Elle peut également être associée à un état d’immunodéficience systémique : sida, déficit immunitaire commun variable(28). Au scanner, le signe prédominant est l’infiltrat en verre dépoli, diffus, bilatéral, « patchy » et périphérique. On retrouve aussi des nodules centro-lobulaires ou sous-pleuraux, des épaississements bronchiques et des septa interlobulaires, et des kystes de 1 à 30 mm dans 68 % des cas(28).
Figure 7. Patiente présentant une LIP dans le cadre d’un Gougerot-Sjörgen.
Quels éléments aident à préciser l’étiologie ?
Il faut avant tout s’interroger sur le contexte clinique.
• Quel est l’âge du patient ? Chez les patients indemnes de pathologie pulmonaire, les kystes sont présents chez 25 % des sujets de plus de 75 ans, indépendamment du tabagisme. En revanche, les kystes pulmonaires ne sont jamais à l’état physiologique chez les patients de moins de 55 ans(29). Il paraît donc nécessaire d’approfondir les explorations chez les sujets jeunes, alors que les patients de plus de 75 ans présentant quelques kystes ne nécessiteront pas forcément d’explorations invasives.
• Quel est le sexe du patient ? La LAM sporadique est exceptionnelle chez les hommes(6).
• Quel est le contexte familial ? Existe-t-il notamment une histoire familiale de pneumothorax ? Des antécédents de pneumothorax familiaux doivent faire évoquer les pathologies suivantes : lymphangioléiomyomatose dans le cadre d’une sclérose tubéreuse de Bourneville, maladie de Marfan, maladie d’Elhers-Danlos et syndrome de Birt-Hogg-Dubé.
• Le patient est-il tabagique ? Le tabac doit faire évoquer une histiocytose pulmonaire à cellules de Langerhans ou, dans un autre contexte radiologique, une pneumonie interstitielle desquamative (DIP).
• Existe-il un contexte néoplasique ? En cas de néoplasie primitive génito-urinaire, ORL, thyroïdienne ou de sarcome, il faut évoquer en premier lieu une métastase kystique (figure 8).
• Existe-t-il des anomalies cutanées ? Selon l’aspect : macules hypomélaniques du tronc, angiofibromes faciaux, plaques fibreuses céphaliques, celles-ci orienteront vers une sclérose tubéreuse de Bourneville(7), ou fibrofolliculomes et trichodiscomes vers un syndrome de Birt-Hogg-Dubé(26).
Figure 8. Patiente de 16 ans suivie pour un carcinome médullaire de la thyroïde, avec des métastases pulmonaires.
Sur le scanner thoracique de 2007, celles-ci correspondaient à des nodules solides, troués ou des cavités à parois
épaisses (A). Sous traitement, on retrouve en 2016 des kystes à parois fines en lieu et place des nodules (B).
Une fois le contexte clinique connu, l’analyse précise des données scannographiques est essentielle puisqu’elle permet un diagnostic étiologique exact dans 72 à 84 % des cas(2).
• Il faut d’abord penser aux anomalies associées et réaliser une acquisition complémentaire abdominopelvienne à la recherche d’une tumeur rénale qui orientera vers une LAM ou un syndrome de Birt-Hogg-Dubé.
• Au niveau du parenchyme pulmonaire :
– les kystes pulmonaires isolés orientent vers une lymphangioléiomyomatose, une histiocytose pulmonaire à cellules de Langerhans et, moins fréquent, un syndrome de Birt-Hogg-Dubé ;
– les kystes associés à des nodules orientent en première intention vers une histiocytose pulmonaire à cellules de Langerhans ou des métastases kystiques ;
– les kystes associés à des plages en dépoli évoquent une pneumocystose en première intention.
En conclusion
Les kystes pulmonaires sont souvent de découverte fortuite au scanner. La recherche d’antécédents familiaux, un contexte néoplasique ou infectieux connu, le statut tabagique permettent d’orienter les diagnostics. Le scanner permet dans un certain nombre de cas de surseoir à la biopsie chirurgicale.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :





