Publié le 10 déc 2019Lecture 8 min
Prise en charge pratique d’un diverticule de Zenker
Franck JEGOUX, CHU de Rennes
Le diverticule de Zenker est le plus connu des diverticules pharyngo-œsophagiens. Il se développe principalement chez des patients de plus de 70 ans et se manifeste par une dysphagie, des régurgitations d’aliments non digérés, et parfois des phénomènes d’inhalation. Le traitement consiste au minimum en une section du muscle cricopharyngien par voie endoscopique (pince autosuturante ou laser CO2) ou cervicale. Plus récemment, des techniques par fibroscope souple ont été décrites.
Signes et bilan cliniques
Les symptômes sont liés à la fois à la sténose (dysphagie avec sensation de blocage alimentaire, stase salivaire, perte de poids et dénutrition) et au diverticule luimême (régurgitations d’aliments non digérés à distance des repas, halitose, reflux de salive au décubitus et toux nocturne) et évoluent souvent depuis plusieurs années (encadré 1) (1). Des fausses routes secondaires surviennent dans 35 % des cas. Une majoration brutale de la dysphagie, l’apparition d’une douleur localisée ou d’épisodes d’hématémèse doivent faire évoquer une cancérisation du diverticule (0,4 à 1,5 %). L’examen clinique peut retrouver un borborygme cervical à la palpation ou l’auscultation, une stase salivaire des sinus piriformes et un signe de la marée à l’examen au miroir ou au nasofibroscope(2), mais il peut être strictement normal (encadré 2).
Examens complémentaires
La confirmation du diagnostic est apportée par le transit œso-gastro-duodénal (TOGD). Le diverticule apparaît sous la forme d’une image d’addition œsophagienne médiane ou paramédiane gauche, et la sténose sous la forme d’une image de soustraction postérieure en regard du muscle cricopharyngien (figure 1).
Figure 1. Transit pharyngo-œsophagien. Le diverticule (flèche bleue) apparaît en addition par rapport à l’œsophage (flèche rouge) et le muscle crico-pharyngien en soustraction (flèche jaune).
Cet examen permet également d’apprécier la taille du diverticule et son retentissement sur l’œsophage (compression). Des images de soustraction au sein du diverticule retrouvées sur toutes les incidences peuvent faire évoquer un cancer intradiverticulaire. Le radiocinéma de déglutition n’est pas systématique, mais il permet d’objectiver des altérations des autres temps de la déglutition (trouble neurovasculaire, presbyphagie, etc.), fréquents chez les sujets âgés. La fibroscopie œso-gastroduodénale (FOGD) n’est indiquée qu’en cas de symptômes évocateurs de pathologies associées du bas œsophage ou de l’estomac (sensation de blocage médio ou basithoracique, vomissements, hématémèse, etc.).
Prise en charge thérapeutique
Bilan préopératoire
Le bilan doit comprendre l’évaluation :
• du retentissement sur la qualité de déglutition : temps de prise des repas, sélection des textures, diminution des quantités, désocialisation… ;
• de l’état nutritionnel: IMC, albuminémie, cinétique de la perte de poids. La dénutrition est présente dans plus de 50 % des cas et est sévère dans 31 % des cas. Le taux de complications post-opératoires est par ailleurs plus fréquent en cas de dénutrition (28,6 % vs 8,3 %)(3) ;
• de l’état respiratoire: pneumopathie, fausses routes… ;
• des comorbidités ;
• de difficultés d’exposition potentielles de la jonction pharyngo-œsophagienne.
Indications (figure 2)
Le traitement du diverticule de Zenker est indiqué :
• chez tous les patients symptomatiques avec retentissement significatif sur la qualité de vie de déglutition ;
• en cas de dénutrition ;
• en cas de complications respiratoires.
Figure 2. Indications et choix thérapeutique.
Endoscopie rigide
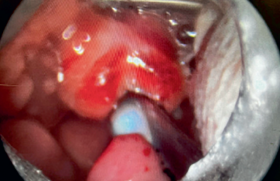
Le but est de sectionner le muscle cricopharyngien qui constitue le mur musculomuqueux entre l’œsophage et le diverticule soit par laser CO2, soit par pince autosuturante initialement utilisée pour la chirurgie laparoscopique. L’exposition du septum séparant la lumière du diverticule de la lumière œsophagienne est réalisée à l’aide d’un diverticuloscope métallique rigide et fait apparaître la « barre cricopharyngée ». Le septum est ensuite sectionné à l’aide du laser CO2 ou d’une pince autosuturante. Dans notre expérience, une section de muqueuse sagittale minimale est suffisante pour exposer et sectionner la totalité du mur musculaire et cette incision est refermée par un ou deux points de suture résorbables (figure 3).
Figure 3. Myotomie du crico-pharyngien par voie endoscopique au laser. La valve antérieure du diverticuloscope est placée dans l’œsophage (flèche bleue) et la valve postérieure est placée dans le diverticule (flèche orange), faisant apparaître la « barre cricopharyngée » en tension correspondant au muscle crico-pharyngien et la muqueuse qui le recouvre. Après incision de la muqueuse sagittale, les fibres musculaires (flèche verte) peuvent être isolées par un palpateur et sectionnées dans leur totalité jusqu’au niveau du fond du diverticule. Dans notre expérience, une incision de la muqueuse minimale est suffisante et est « transversalisée » par un point de suture au Vicryl 4/0.
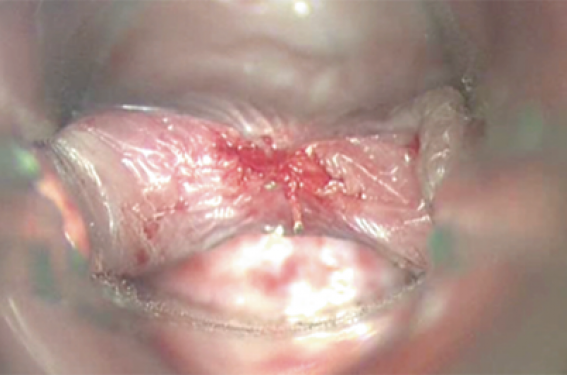
Une fois le muscle sectionné, la mise en place d’une sonde est aisée (figure 4). Le taux d’échec de ces procédures endoscopiques est significativement plus élevé que par voie externe(18,4 % vs 4,2 % ; p < 0,001). La principale différence réside dans l’échec à court terme (14,5 % vs 1,3 %), notamment en raison de problèmes d’exposition (5,2 %) principalement liés au défaut d’extension cervicale ou d’ouverture buccale. L’évaluation pré-opératoire de la faisabilité (scores anesthésiologiques d’exposition laryngée) est donc capitale.
Figure 4. L’ouverture initialement réduite de l’œsophage (flèche orange) par la sténose liée au défaut de relâchement du muscle cricopharyngien (flèche bleue) en avant du diverticule (flèche verte) est normalisée par la myotomie. Une sonde nasogastrique est mise en place jusqu’à reprise de l’alimentation à J1.
Le taux de complications postopératoires est néanmoins plus faible que par voie externe : 7,9 % par laser et 4,9 % par pince autosuturante. Les principales complications sont la perforation œsophagienne avec emphysème (3 %), la médiastinite (1,2 %), les lésions dentaires, les plaies de langues, l’anesthésie du nerf lingual et les plaies pharyngées liées à l’exposition. Le taux de mortalité est de 0,4 %. La taille du diverticule pourrait avoir une importance dans le choix de la technique. En effet, pour les diverticules de moins de 3 cm, le pourcentage de patients asymptomatiques en post-opératoire est significativement plus élevé après les procédures ouvertes (98 %) qu’après traitement endoscopique (57 %), que ce soit par technique laser (50 %) ou agrafage (58 %), alors que ce n’est pas le cas pour les diverticules de 3 cm ou plus (97 % vs 88 %, respectivement)(4).
Traitement chirurgical par voie cervicale
Il est effectué sous anesthésie générale, par abord externe cervical gauche. Le diverticule peut être réséqué (diverticulectomie) (figure 5), mais cela expose à un risque accru de fistule, de médiastinite et de sténose.
Figure 5. Diverticulectomie. Ce geste ne doit être réalisé qu’en cas d’échec des techniques conservatrices. Une bougie de dilatation (en orange dans le diverticule) a été mise en place pour favoriser le repérage du diverticule.
Il est préférable de réaliser une diverticulopexie (figure 6) par fixation du diverticule plus haut sur le fascia prévertébral ou le constricteur du pharynx vers le haut. Dans tous les cas, une myotomie du muscle cricopharyngien doit impérativement y être associée et réalisée sur une hauteur suffisante (4-5 cm) (figure 7).
Figure 6. Diverticulopexie. Le diverticule (flèche bleue) est fixé en arrière du pharynx au fascia prévertébral (point orange) vers le haut.
Figure 7. Myotomie du muscle crico-pharyngien (flèche bleue) par voie cervicale. Ce temps est réalisé après repérage du diverticule (flèche orange), du nerf laryngé inférieur et du constricteur du pharynx (flèche verte). La section doit être réalisée sur une hauteur suffisante (4 cm) et concerner toutes les fibres musculaires sous- et sus-jacente au faisceau principal du muscle crico-pharyngien (référence méta-analyse Verdonck 2015). Le diverticule totalement isolé de l’œsophage et du pharynx peut ensuite faire l’objet soit d’une diverticulectomie soit d’une diverticulopexie (préférable).
La voie cervicale a l’avantage de pouvoir être effectuée chez des patients dont l’exposition endoscopique est impossible et de conduire aux plus faibles taux d’échecs (4,2 % de persistance ou de récidive précoce des symptômes à 1 an), y compris à long terme, la faisant préférer chez les sujets très jeunes pour certains auteurs. Cela doit cependant être mis en balance avec un taux significativement plus élevé de complications de 11 % avec un risque de fistule (3,7 %), de paralysie récurrentielle (3,4 %) et d’hématome (2,2 %). Le taux de mortalité de la procédure est de 0,9 %.
Endoscopie souple
Introduite en 1995, cette technique présente l’avantage d’être moins invasive que la voie endoluminale rigide, car elle peut être réalisée sous anesthésie locale et par conséquent chez les patients avec comorbidité et risque de difficultés d’exposition au diverticuloscope (distance thyro-mentonnière réduite, IMC élevé, dentition proéminente, arthrose cervicale). Différents procédés de section du muscle peuvent être utilisés : needle-knife avec courant ENDOCUT®, coagulation au plasma argon, couteaux de dissection sous-muqueuse, pince coagulante. Le taux d’échec est néanmoins beaucoup plus important qu’avec les approches précédentes sous anesthésie générale, de l’ordre de 29 %(5,6).
Le taux de complications est aussi plus élevé que pour les techniques endoscopiques rigides, de l’ordre de 14,3 % : emphysème (8 %), fistule (5,6 %), hématome (0,4 %) et médiastinite (0,4 %). Dans une métaanalyse de 71 études, J. Verdonck et coll. ont comparé l’efficacité et la tolérance des quatre techniques(7). Les auteurs ont démontré que les techniques ouvertes étaient plus efficaces (96 % vs 81 %) mais qu’elles génèraient plus de complications (11 % vs 7 %) que les techniques endoscopiques. Les résultats tendent à s’amenuiser avec le temps après voie endoscopique. Les résultats d’efficacité après laser et pince autosuturante sont peu différents. Les complications sont un peu plus fréquentes après laser, mais il n’existe pas de comparaison prospective directe. Dans cette métaanalyse, les études avec technique laser sont anciennes (1995 à 1999) et la technique a évolué vers des incisions muqueuses minimales. La taille du mur diverticulo-œsophagien résiduel en post-opératoire est plus importante après technique en pince autosuturante mais n’est pas corrélée à de moins bons résultats(8).
Suites postopératoires
Après voie endoscopique, la reprise alimentaire peut être effectuée dès le lendemain pour le laser et à J3 en moyenne par technique de pince autosuturante. La durée moyenne d’hospitalisation est de 3,9 jours. Après voie cervicale, la reprise alimentaire se fait à J8 le plus souvent et la durée de séjour est de 8,4 jours en moyenne(9,10). L’amélioration immédiate des symptômes est notée dans plus de 95 % des cas, quelle que soit la technique. Néanmoins à 18 mois, on note une récidive de la symptomatologie dans 30 % des cas après endoscopie souple(11), 15 % après endoscopie rigide et 5 % après voie cervicale(12). Le taux de réintervention reste néanmoins faible, autour de 4 %(13). Ces échecs sont accessibles à un nouveau traitement par voie endoscopique ou par voie cervicale. À noter qu’après un traitement endoscopique du diverticule, la poche est encore apparente sur les transits œso-gastroduodénaux postopératoires dans 66 % des cas et sa présence n’est pas corrélée aux symptômes(7). La persistance d’un diverticule sans symptomatologie ne doit donc pas faire suspecter une récidive ou motiver une réintervention.
En pratique
L’indication est posée sur la présence d’une symptomatologie significative.
Le bilan comprend l’évaluation du retentissement nutritionnel et respiratoire, des comorbidités, de l’exposition, et de la faisabilité d’une anesthésie générale.
Le traitement par endoscopie rigide soit par laser soit par pince autosuturante est actuellement le traitement de première intention.
En cas de difficulté d’exposition, la voie cervicale doit être préférée.
En cas d’impossibilité d’anesthésie générale, la voie endoscopique souple doit être discutée.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :