ORL
Publié le 16 jan 2019Lecture 11 min
Conduite à tenir devant un nodule thyroïdien
Marie BIENVENU-PERRARD, Centre de pathologie et d’imagerie ; Service de médecine nucléaire, hôpital Cochin, Paris
Les nodules thyroïdiens sont fréquents, le plus souvent bénins (95 % des nodules) et de découverte fortuite. Une démarche diagnostique raisonnable est donc nécessaire lors de la découverte d’un nodule thyroïdien. Le dosage de la TSH et l’échographie cervicale (thyroïdienne et ganglionnaire) sont les deux examens à réaliser en première intention. L’échographie permet de mesurer, situer et caractériser le nodule (score EU-TIRADS permettant une stratification du risque de malignité des nodules thyroïdiens). Selon la taille et le score EU-TIRADS, une cytoponction échoguidée peut être indiquée, elle permettra de sélectionner les patients à opérer.
Le nodule thyroïdien est défini par une hypertrophie localisée de la glande thyroïde (nodulus = petit nœud).
Circonstances de découverte
Seulement 4 % de nodules sont découverts à la palpation (nodules superficiels et/ou volumineux). Le plus souvent (84 % des cas), il s’agit d’incidentalomes découverts à l’occasion d’un scanner, d’une IRM, d’un écho-Doppler des troncs supra-aortiques, d’une tomographie par émission de positons, d’une échographie cervicale réalisée pour une autre raison(1). Ils peuvent aussi être mis en évidence au cours de l’exploration d’une hyperthyroïdie.
Prévalence et facteurs de risque
La prévalence des nodules est de 4 à 7 % à la palpation, 60 % en échographie. Les séries autopsiques retrouvent environ 60 % de micronodules et 11 % de microcarcinomes. La fréquence des nodules augmente avec l’âge. Les nodules sont 2 à 3 fois plus fréquents chez la femme.
La carence iodée et la grossesse sont des facteurs favorisant l’apparition ou l’accroissement de taille des nodules(2). Certaines maladies rares prédisposent au cancer de la thyroïde et aux nodules thyroïdiens : NEM 2 (mutation du gène RET: 20–25 % des carcinomes médullaires de la thyroïde), maladie de Cowden, polypose colique familiale (mutation du gène APC), complexe de Carney, syndrome de McCune-Albright, acromégalie. L’irradiation cervicale accroît le risque de nodules et de cancer surtout en cas d’irradiation durant l’enfance.
Histoire naturelle
L’évolution naturelle est difficilement prévisible : modification de taille, apparition de nouveaux nodules au sein d’un goitre multinodulaire. Concernant la modification de taille, environ 10 à 30 % des nodules progressent (la progression est le plus souvent lente et n’est pas un signe de malignité), 15 à 25 % diminuent, la majorité reste stable(3).
Nature des nodules thyroïdiens
Quatre-vingt-quinze pour cent des nodules sont bénins : adénomes vésiculaires, kystes (simples ou hémorragiques), thyroïdites (chronique ou sub-aiguë). Parmi les nodules malins, le carcinome papillaire et le carcinome vésiculaire sont les plus fréquents suivis du carcinome médullaire de la thyroïde (CMT). Le carcinome anaplasique, le lymphome primitif de la thyroïde et les métastases intrathyroïdiennes (rein, sein, poumon, etc.) sont plus rares mais peuvent se présenter sous la forme d’un nodule(4). Les nodules thyroïdiens sont très fréquents. Le cancer thyroïdien est rare (environ 5 % des nodules) et de bon pronostic dans sa forme différenciée, la plus fréquente.
Exploration d'un nodule thyroïdien
Le but de l’exploration d’un nodule est d’identifier sa nature :
• Le nodule autonome (anciennement appelé nodule « chaud »), bénin mais responsable d’une hyperthyroïdie clinique ou infraclinique(5,6).
• Le nodule malin nécessitant une prise en charge chirurgicale.
• Le nodule bénin pour lequel une surveillance peut être envisagée en l’absence de gêne, ou un traitement chirurgical ou par thermoablation proposé en cas de gêne.
Interrogatoire et examen clinique
Les antécédents personnels ou familiaux de pathologies thyroïdiennes, les maladies ou facteurs favorisants sont à rechercher à l’interrogatoire. De même, il faudra rechercher des signes d’hypothyroïdie ou d’hyperthyroïdie, des signes de compression (dysphagie, dysphonie, dyspnée). Ces éléments ainsi que les circonstances de découverte et l’examen cliniques orientent vers certaines étiologies(7,8) :
– nodule douloureux, d’apparition brutale, en faveur d’un kyste hémorragique ;
– nodule dur associé à des signes de compression et parfois des adénopathies en faveur d’un nodule malin nécessitant une prise en charge rapide ;
– nodule associé à des signes cliniques d’hyperthyroïdie en faveur d’un nodule autonome (adénome toxique).
Bilan biologique
Un dosage de la TSH doit être réalisé systématiquement lors de la découverte d’un nodule thyroïdien. Le taux de TSH déterminera la suite des examens à réaliser :
• Si la TSH est basse (< 0,8), une scintigraphie thyroïdienne (à l’iode 123 plutôt qu’au technétium) à la recherche du caractère autonome du nodule (nodule hypercontrasté), idéalement couplée à une échographie thyroïdienne doit être envisagée (figure 1). Les nodules hyperfixants sont bénins (pas d’indication à une cytoponction) et peuvent être traités par iode 131 à visée préventive ou pour traiter une hyperthyroïdie.
Figure 1. Nodule mixte (A), à vascularisation mixte intense (B), situé à la jonction tiers moyen - tiers inférieur du lobe thyroïdien droit et correspondant à un nodule hypercontrasté sur la scintigraphie à l’iode 123 (C).
• Si la TSH est normale ou haute, une échographie thyroïdienne doit être réalisée. La scintigraphie a peu d’intérêt. Le dosage de thyroglobuline n’est pas utile, il ne permet pas de déterminer la nature bénigne ou maligne des nodules. Il est utile dans la surveillance des cancers thyroïdiens opérés. Le dosage de la calcitonine ne doit pas être systématique. Il peut être demandé en cas de suspicion de CMT (contexte de néoplasie endocrinienne multiple [NEM 2], clinique évocatrice [flush, diarrhées], cytoponction en faveur d’un CMT) et en préopératoire.
Devant un nodule thyroïdien, un interrogatoire (circonstances de découverte, antécédents familiaux et personnels (irradiation cervicale dans l’enfance, etc.), un examen clinique et un dosage de TSH doivent être réalisés en première intention. La poursuite des investigations et le degré d’urgence dépendra de ces premiers éléments (figure 2).
Figure 2. Arbre décisionnel lors de la découverte d’un nodule thyroïdien.
L’échographie thyroïdienne
Elle a un rôle central dans la prise en charge des nodules. Elle permet de distinguer les nodules bénins qui peuvent être surveillés des nodules suspects qui nécessitent une poursuite des investigations, l’objectif étant d’éviter des chirurgies inutiles sans méconnaître un cancer thyroïdien(9-13).
Les recommandations de l’European Thyroid Association (ETA) publiées en juin 2017 permettent d’établir le score EU-TIRADS (European Thyroid Imaging and Reporting Data Systems) correspondant à une stratification échographique du risque de malignité des nodules thyroïdiens(14). Elles comportent un lexique, un compte rendu standardisé, une classification des nodules (bénin, faible risque, risque intermédiaire ou risque élevé de malignité) et définissent les indications de cytoponction qui dépendent de la taille du nodule et de son score permettant une harmonisation des pratiques, l’échographie restant un examen très opérateur-dépendant. Toute échographie thyroïdienne doit comporter un schéma sur lequel seront rapportés et numérotés les nodules (figure 3). Chaque nodule significatif doit être mesuré dans les trois plans et son volume précisé. Ces éléments permettront un suivi évolutif satisfaisant des nodules et sont indispensables en cas de thyroïde multinodulaire.
Figure 3. Exemple de schéma pour localiser et numéroter les nodules thyroïdiens.
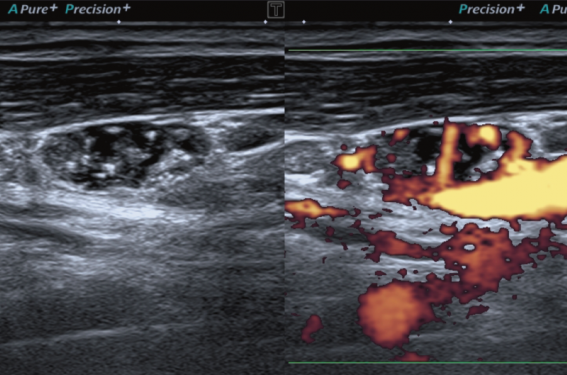
Il existe quatre signes cardinaux de forte suspicion de malignité : la présence des microcalcifications, la forme non ovale, les contours irréguliers et le caractère fortement hypoéchogène du nodule. L’analyse de la forme, des contours et du contenu du nodule permet de le classer dans l’une des 4 catégories ci-dessous (figure 4) :
• Catégorie bénigne (EU-TIRADS 2) : risque de malignité proche de 0 %. Il s’agit des nodules kystiques purs et des nodules entièrement spongiformes (nodule constitué de fines cloisons isoéchogènes séparant des logettes kystiques) (figure 5). Il n’y a pas indication à réaliser de cytoponction à visée diagnostique dans cette catégorie. La ponction peut être réalisée à visée évacuatrice en cas de gêne esthétique ou fonctionnelle.
• Catégorie à faible risque (EUTIRADS 3) : risque de malignité 2 à 4 %. Il s’agit de nodules de forme ovale, de contours réguliers, entièrement iso- ou hyperéchogènes par rapport au parenchyme thyroïdien, sans signe de forte suspicion (figure 6). La cytoponction est indiquée pour les nodules > 20 mm. Dans cette catégorie, on retrouve les amas nodulaires isoéchogènes. Seuls les nodules > 10 mm doivent être décrits dans le compte rendu.
• Catégorie à risque intermédiaire (EU-TIRADS 4) : risque de malignité 6 à 17 %. Elle correspond aux nodules de forme ovale, de contours réguliers, modérément hypoéchogènes par rapport au parenchyme thyroïdien sans signe de forte suspicion (figure 7). La cytoponction est indiquée lorsqu’ils dépassent 15 mm de grand axe. Seuls les nodules > 5 mm doivent être décrits.
• Catégorie à risque élevé de malignité (EU-TIRADS 5) : risque de malignité 26 à 87 %. Il s’agit des nodules comportant au moins un signe de forte suspicion : forme non ovale, contours irréguliers (spiculés ou lobulés), microcalcifications ou hypoéchogénicité marquée (plus hypoéchogène que les muscles superficiels) (figure 8). La cytoponction est indiquée lorsque le nodule atteint 10 mm. Une première cytoponction bénigne doit être répétée à 3 mois pour diminuer le taux de faux négatifs. Ces nodules doivent être décrits quelle que soit leur taille.
Figure 4. Score EU-TIRADS et indications de cytoponction.
Figure 5. Nodules classés EU-TIRADS 2 (bénins). A : kystique comportant des ponctuations hyperéchogènes avec artéfacts en queue de comète correspondant à des granulations colloïdales. B : spongiforme.
Figure 6. Nodules classés EU-TIRADS 3 (faible risque), isoéchogènes ne comportant aucun signe de forte suspicion. A : solide avec fin halo périphérique. B : mixte.
Figure 7. Nodule classé EU-TIRADS 4 (risque intermédiaire), modérément hypoéchogène ne comportant aucun signe de forte suspicion.
Figure 8. Nodules classés EU-TIRADS 5 (risque élevé de malignité) comportant au moins un signe de forte suspicion parmi les 4. A : forme non ovale (nodule plus épais que large) et hypoéchogénicité marquée. B : contours irréguliers. C : microcalcifications.
D’autres signes échographiques, appelés signes accessoires, doivent être recherchés ; ils ne modifient pas le score EU-TIRADS mais modulent le risque de malignité dans les catégories 3 et 4. Certains signes diminuent ce risque : la présence d’un fin halo périphérique, d’une composante kystique, de granulations colloïdales, une vascularisation périphérique, l’absence de macrocalcifications ou la présence d’une coque calcique complète, une rigidité basse en élastographie. D’autres signes majorent le risque : l’absence de halo ou un halo épais, l’échostructure solide, l’absence de granulations colloïdales, les macrocalcifications périphériques discontinues, la suspicion d’extension extracapsulaire, la vascularisation centrale, la rigidité élevée.
L’élastographie n’est pas intégrée au score car elle comporte une faible reproductibilité interobservateur et des limites : les nodules isthmiques, profonds, mixtes, comportant des macrocalcifications ou volumineux. Elle peut être utilisée en plus de l’échographie en mode B pour sa valeur prédictive négative élevée. L’échographie ganglionnaire doit être systématique à la recherche d’adénopathies spécifiques (figure 9).
Figure 9. Adénopathies spécifiques microcalcifications, logettes kystiques et vascularisation anarchique.
Les microcalcifications, une vascularisation anarchique, un aspect thyromimétique ou des logettes kystiques dans un ganglion doivent faire suspecter une origine thyroïdienne et le primitif doit être recherché. La présence d’une adénopathie spécifique ne modifie pas le score EU-TIRADS.
Les signes cardinaux de forte suspicion de malignité en échographie sont : la présence des microcalcifications, la forme non ovale, les contours irréguliers, le contenu fortement hypoéchogène. Un nodule comportant au moins un de ces signes est classé EU-TIRADS 5. Le score EU-TIRADS permet de détecter 96 % des carcinomes thyroïdiens.
La cytoponction
La cytoponction à l’aiguille fine est un geste simple, rapide et peu invasif. Elle doit être réalisée sous guidage échographique. Cette technique a permis de réduire significativement le nombre de thyroïdectomies(9). Les indications de cytoponction dépendent du score EU-TIRADS et de la taille du nodule (figure 4).
Doivent être ponctionnés :
– les nodules classés EU-TIRADS 3 de plus de 20 mm ;
– les nodules classés EU-TIRADS 4 de plus de 15 mm ;
– les nodules classés EU-TIRADS 5 de plus de 10 mm.
La cytoponction des nodules de taille ≥ 10 mm est réalisée en cas de recherche de carcinome thyroïdien primitif devant un ganglion suspect ou une métastase à distance. Elle peut être également discutée pour un nodule classé EU-TIRADS 5 de topographie juxta-capsulaire, polaire supérieur ou dans un contexte à risque. Dans les autres cas, la surveillance active (échographie de contrôle à 6 mois) peut être proposée.
La terminologie de la classification du National Cancer Institute/ Bethesda 2008 (tableau) comporte 6 catégories fondées sur des critères cytologiques précis qui ont fait l’objet d’un descriptif publié dans un atlas. Chaque catégorie cytologique est associée à un risque de malignité et à une conduite à tenir thérapeutique, ce qui permet d’harmoniser la prise en charge du patient(15).
Seul l’examen histologique permet de catégoriser définitivement les lésions folliculaires. En effet, la malignité des néoplasies folliculaires est basée sur des critères histologiques (invasion vasculaire et/ou capsulaire). L’examen cytologique ne permet donc pas de distinguer un adénome folliculaire (non invasif) d’un carcinome folliculaire (invasif).
Pour les tumeurs thyroïdiennes, la cytologie joue un rôle diagnostique essentiel et doit préciser le type de cancer (carcinome papillaire, carcinome médullaire, carcinome anaplasique, lymphome, métastases).
La cytologie en milieu liquide permet de compléter par des études immunocytochimiques ou de biologie moléculaire.
La cytoponction sous guidage échographique est indiquée pour les nodules de plus de 20 mm dans la catégorie EU-TIRADS 3, les nodules EU-TIRADS 4 de plus de 15 mm et les nodules EUTIRADS 5 de plus de 10 mm.
Les résultats doivent être exprimés selon la terminologie de Bethesda comportant 6 catégories associées à un risque de malignité et à une conduite à tenir.
Surveillance des nodules thyroïdiens
Lorsque l’échographie réalisée par un opérateur entraîné ne décrit pas de nodule suspect ou compressif et que les cytoponctions des éventuels nodules le nécessitant sont bénignes, une surveillance échographique peut être proposée à intervalles progressivement espacés : premier contrôle entre 6 et 18 mois puis tous les 2 ans, 3 ans et 5 ans en cas de stabilité.
Une cytoponction de contrôle peut être réalisée en cas d’augmentation volumétrique significative (2 mm dans au moins deux diamètres), ou modification des caractéristiques échographiques du nodule.
La surveillance active des microcarcinomes fait également partie des nouvelles perspectives.
Stratégies thérapeutiques
La prise en charge dépend des résultats des explorations (biologie, imagerie) et de la gêne présentée par le patient.
La chirurgie est indiquée pour les nodules suspects et malins en cytologie et en cas de goitre multinodulaire compressif. Le type de chirurgie (lobo-isthmectomie ou thyroïdectomie totale avec ou sans curage ganglionnaire) dépend des résultats de la cytoponction et de l’éventuelle étude anatomopathologique extemporanée. En cas de cancer différencié, une totalisation isotopique par iode 131 peut être nécessaire en complément de la thyroïdectomie totale.
La thermoablation (laser, radiofréquence, ultrasons focalisés de haute intensité) peut être envisagée en cas de nodule solitaire ou dominant bénin (deux cytoponctions bénignes) entraînant une gêne fonctionnelle ou esthétique chez un patient désireux d’éviter la chirurgie ou présentant des comorbidités.
L’alcoolisation est une alternative à la lobectomie en cas de kyste symptomatique.
Pour les nodules autonomes, un traitement par iode 131 peut être envisagé.
Le traitement hormonal freinateur n’a plus d’indication dans ce contexte.
En l’absence de nodule suspect ou de gêne, la surveillance est proposée avec un suivi clinique, biologique (TSH) et échographique.
Conclusion
Compte tenu de la grande fréquence des nodules thyroïdiens, le plus souvent bénins et asymptomatiques, la démarche diagnostique doit être raisonnable pour éviter sur-diagnostic et sur-traitement. Le dosage de la TSH et l’échographie thyroïdienne (avec score EU-TIRADS, cartographie, mesure du volume des nodules et bilan ganglionnaire) sont systématiques afin de dépister les nodules malins (cytoponction échoguidée) et les nodules autonomes (scintigraphie à l’iode 123) nécessitant un traitement spécifique. Pour les nodules bénins, la surveillance est le plus souvent proposée. En cas de gêne, une prise en charge chirurgicale ou un traitement par thermoablation peuvent être discutés.
Actuellement, le principal problème de prise en charge concerne les microcarcinomes (carcinomes infra-centimétriques) : traitement chirurgical ou surveillance active ?
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :