Apnées du sommeil
Publié le 09 avr 2015Lecture 11 min
Stimuler le grand hypoglosse pour traiter les apnées obstructives du sommeil
V. ATTALI, Service pathologies du sommeil, troubles respiratoires et neurologiques du sommeil, hôpital La Pitié-Salpêtrière, Paris
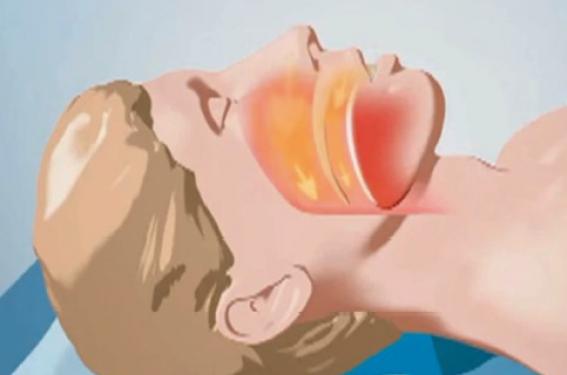
La stimulation implantée du nerf du grand hypoglosse (XII), nerf moteur des muscles de la langue dilatateurs du pharynx, est une thérapie innovante du syndrome sévère d’apnées obstructives du sommeil. La stimulation du XII durant le sommeil permet de maintenir ouvertes les voies aériennes supérieures et d’éviter la survenue des apnées obstructives. Les premières études cliniques ont montré chez les patients répondeurs une réduction significative de la fréquence de ces apnées et une bonne tolérance. Ce traitement est encore au stade de développement et n’est pas disponible en pratique clinique courante en France, mais de larges études sont en cours.
Le syndrome d’apnées obstructives du sommeil (SAOS) est caractérisé par des épisodes répétitifs de collapsus des voies aériennes supérieures (VAS) durant le sommeil. Le SAOS sévère est défini par un index d’apnées-hypopnées (IAH) > 30/heure. Les événements respiratoires obstructifs répétés entraînent une hypoxie intermittente et une fragmentation du sommeil qui induisent des conséquences systémiques, principalement la somnolence diurne et ses risques accidentels, et des pathologies cardiovasculaires(1). Le traitement de référence du SAOS sévère est la ventilation en pression positive continue nocturne (PPC) qui consiste à appliquer une pression positive dans les VAS, afin de les maintenir ouvertes. À long terme, on estime toutefois qu’environ 15 à 20 % des patients ne sont pas observants. L’orthèse d’avancée mandibulaire sur mesure titrable permet de traiter les patients intolérants à la PPC, mais elle n’est pas utilisable par tous. La stimulation implantée du XII, actuellement en développement chez les patients sévères intolérants à la PPC offrira sans doute de réelles perspectives thérapeutiques. Bases théoriques de la stimulation XII : l’instabilité des VAS au cours du sommeil Chez les patients atteints de SAOS, il existe durant le sommeil, une instabilité des VAS responsable d’un collapsus du pharynx lors de l’inspiration(2). Le pharynx est une structure musculaire souple, encadrée par deux structures rigides, souplesse nécessaire pour assurer les fonctions de phonation et de déglutition, mais qui constitue une zone de faiblesse pour la ventilation. Lors de l’inspiration, le pharynx subit en effet une pression négative qui tend à le fermer. La stabilité en ouverture des VAS, au cours du cycle ventilatoire, nécessite donc la mise en jeu d’un phénomène dynamique adaptable, assuré par l’activité des muscles dilatateurs des VAS, dont le principal est un muscle lingual, le génioglosse. Ces muscles ont une activité phasique, synchrone avec le diaphragme, mais précédant sa contraction et permettent aux VAS de rester ouvertes à l’inspiration. À ce titre, ils sont considérés comme des muscles respiratoires accessoires. Leur activité diminue au cours du sommeil, mais reste suffisante chez le sujet sain pour maintenir les VAS ouvertes. Dans le SAOS, il existe au contraire un défaut de stabilité des VAS au cours du sommeil, dont la cause est souvent anatomique mais pas exclusivement et qui est aggravée en décubitus par la bascule de la langue en arrière. Une altération de la commande des muscles des VAS a également été mise en évidence dans le SAOS. Ainsi, l’activité du génioglosse est plus élevée à l’éveil(3) et sa commande centrale est parfois altérée(4). Le traitement du SAOS par stimulation du XII s’appuie sur ces dernières données physiopathologiques, puisqu’il a pour but de restaurer la stabilité des VAS par la contraction optimale des muscles dilatateurs du pharynx. La stimulation du XII durant le sommeil induit la contraction des muscles dilatateurs du pharynx et a pour but de restaurer une stabilité optimale des VAS. Stimuler directement le génioglosse n’est pas efficace Le génioglosse est un muscle pair extrinsèque de la langue et le plus volumineux considéré comme le principal muscle dilatateur des VAS. Très schématiquement, on distingue une partie postérieure, riche en fibres musculaires de type I, qui ouvre le pharynx et une partie antérieure riche en fibres de type II utiles à la parole et à la mastication. Ainsi, il agit en protraction, mais il n’est pas nécessaire de tirer la langue pour stabiliser le pharynx. La stimulation du génioglosse entraîne une augmentation du débit inspiratoire, maximale lorsque la stimulation est appliquée à l’inspiration. Cette notion est particulièrement importante, puisque un des stimulateurs en développement n’est activé qu’à l’inspiration(5). La stimulation isolée du génioglosse (percutanée ou par aiguilles) n’a pu être utilisée en thérapeutique car elle réveillait les patients et n’était pas efficace. La stabilité des VAS au cours du cycle respiratoire est en effet un phénomène complexe qui n’est pas lié à l’action isolée du génioglosse, mais qui découle paradoxalement d’une action synergique avec ses antagonistes. Le principal muscle antagoniste, l’hypoglosse ferme les VAS lorsqu’on le stimule de manière isolée, mais à l’inspiration et en association au génioglosse, il a au contraire un effet de stabilisation et d’ouverture des VAS(6). Les muscles antagonistes sont d’ailleurs toujours activés lors de l’inspiration(7) et permettent d’assurer une stabilité optimale aux VAS. Stimulation du XII dans le SAOS Deux systèmes sont très avancés dans leur développement. Ils fonctionnent selon un principe commun, la stimulation du XII mais diffèrent sur certains points : – la stimulation synchronisée sur l’inspiration, ciblée sur le génioglosse et la dépolarisation totale du nerf pour Inspire ; – la stimulation continue d’intensité moindre, avec dépolarisation partielle ciblant une combinaison de muscles impliqués dans la stabilité des VAS pour Imthera. Le XII est un nerf crânien pair, purement moteur qui innerve le génioglosse mais également ses antagonistes. Sa stimulation a par conséquent plus de chances de reproduire un effet proche de la physiologie. Plus la stimulation du XII est distale ou située sur sa branche médiale, plus elle cible a priori le génioglosse. Néanmoins, il existe une forte variabilité interindividuelle. Ainsi, la stimulation peut en fonction du site, et donc des groupes musculaires activés, induire une ouverture avec une meilleure stabilité ou, au contraire, une fermeture des VAS. Il est donc fondamental de bien positionner le stimulateur sur le nerf afin de produire l’effet recherché. Une stimulation unilatérale de l’hémi-langue homolatérale est suffisante pour stabiliser les VAS. Deux stimulateurs totalement implantés (Inspire et Imthera) sont actuellement très avancés dans leur développement. Ils ont un certain nombre de points communs et des différences notables indiquées dans le tableau. Tous deux stimulent de manière unilatérale et sont posés chirurgicalement, généralement à droite, en abordant le XII au niveau du cou pour fixer l’électrode de stimulation. Une deuxième incision est réalisée dans la région sous-claviculaire pour la mise en place du boîtier de stimulation, les deux parties étant reliées par un câble interne. Le système Inspire nécessite une troisième incision pour positionner un détecteur d’inspiration sous le grand pectoral dans l’espace intercostal entre la 4e et la 6e côte. Le système est titré avant sa première utilisation, à distance de l’intervention. On détermine à l’éveil, puis lors d’une endoscopie sous sédation, les seuils de stimulation et les intensités qui seront utilisées lors du traitement. Pour le système Imthera, on fixe également le nombre de contacts actifs. La stimulation entraîne l’ouverture des VAS et permet d’augmenter significativement le débit inspiratoire au cours du sommeil (figures 1, 2 et 3). Figure 1. Activité du stimulateur Imthera enregistré chez un patient au cours du sommeil lors de la première nuit de stimulation. Lorsque le stimulateur n’est pas activé, le patient ronfle (signal du bas « phono ») et le débit est limité (signal du haut NAF2P). On visualise la stimulation sur l’électromyogramme du mentonnier (EMG1). Lorsque le stimulateur est actif, le ronflement disparaît et le débit augmente. Figure 2. Endoscopie sous sédation légère chez un patient implanté avec le système Imthera. A : à gauche, le stimulateur n’est pas activé. On visualise bien l’obstruction des voies aériennes supérieures (VAS). B : à droite, le stimulateur est actif, la base de langue et l’épiglotte sont repoussées vers l’avant permettant d’ouvrir les VAS. Figure 3. Patient implanté avec le stimulateur Imthera à la Pitié-Salpêtrière en juin 2013. Photographie réalisée à distance de l’intervention lors de la première titration du stimulateur à l’éveil. On a demandé ici au patient d’ouvrir la bouche, mais la stimulation n’entraîne pas d’ouverture buccale, ni de protraction de la partie antérieure de la langue. Ici un seul des 6 contacts est activé et on visualise bien l’effet unilatéral de la stimulation sur la partie postérieure de la langue qui s’abaisse et ouvre les voies aériennes en arrière. Les premières études cliniques ont montré des résultats prometteurs et l’absence d’effet délétère à court terme chez un petit nombre de patients modérés à sévères, majoritairement des hommes, non obèses ou avec une obésité modérée. La réponse était définie par une réduction d’au moins 50 % de l’IAH ou un IAH < 20/heure. L’étude Inspire(8) a comporté deux phases : la première a identifié des critères prédictifs de réponse, qui ont été ensuite utilisés comme critères de sélection pour la phase II. Dans la phase I, 22 patients avec un IAH basal de 43,6 ± 18,4 et un IMC 29,8 ± 2,7 kg/m2 ont été inclus. Six patients étaient répondeurs à 6 mois avec un IAH qui passait de 26,1 ± 4,5 à 7,7 ± 4,1 (p < 0,01). L’étude Imthera(9) a inclus 14 patients (13 implantés, 9 répondeurs) avec un IAH basal de 45,2 ± 17,8 et un IMC 31 ± 3 kg/m2. À 3 mois, l’IAH était de 21,7 ± 19,9 (p < 0,001) et l’effet se maintenait à 12 mois avec un IAH de 21,0 ± 16,5 (p < 0,001). Les premières données cliniques ont montré une réduction significative de l’IAH chez les patients répondeurs. Les facteurs de réponse au traitement sont partiellement connus mais encore en cours d’investigation. Des études cliniques sur un grand nombre de patients sont en cours. Quels sont les critères prédictifs de réponse ? Dans l’étude Inspire, un IAH ≤50/heure et un IMC ≤ 32 kg/m2 étaient associés significativement à une meilleure réponse. Ces critères ont été utilisés pour sélectionner 9 autres patients dans la phase II de l’étude et ont permis d’améliorer significativement le taux de succès, avec une réduction significative de l’IAH de 38,9 ± 9,8 à 10,0 ± 11,0 (p < 0,01) à 6 mois. Une endoscopie des VAS sous sédation a également permis dans cette étude d’écarter les patients présentant un collapsus concentrique complet et d’identifier certains critères morphologiques prédictifs de réponse. Peut-on attendre un bénéfice à long terme ? Il est probable que la stimulation prolongée induise une amélioration de la fonction musculaire. Ainsi dans l’étude Imthera, un effet rémanent à 1 an a été observé, puisque l’IAH était de 41,3 ± 13,3 à l’inclusion, et à 1 an, de 15,0 ± 4,8 sous stimulation et de 16,4 ± 9,3 sans stimulation(10). La stimulation pourrait avoir un effet de réentraînement sur les muscles des VAS. Conclusion Les premiers résultats de stimulation du XII dans le SAOS sont très encourageants, néanmoins l’intégration de ce traitement en pratique clinique n’est pas encore d’actualité et il est également trop tôt pour une estimation du coût. La tolérance à long terme devra impérativement être évaluée et les risques théoriques de dénervation liée à la stimulation prolongée particulièrement recherchés. Des études cliniques internationales de grande envergure auxquelles la France participe, sont actuellement en cours et devraient permettre de confirmer à moyen terme l’efficacité des systèmes en développement. Les critères prédictifs de réponse devront être précisés. En effet, si les patients répondeurs ont des IAH globalement moins élevés, il semble difficile de limiter l’indication aux patients modérément sévères. Chez les patients les plus sévères, un effort devra être fait pour rechercher d’autres critères prédictifs de succès ou d’échec de la stimulation. Des progrès restent à faire dans la titration du traitement en termes d’intensité et de séquence. Une miniaturisation du stimulateur peut également être espérée, de même qu’une plus grande autonomie. Enfin, la stimulation pourrait avoir un effet assimilable à celui d’une « rééducation » active des muscles des VAS et, à ce titre, des traitements séquentiels pourraient être proposés.
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :