Publié le 03 fév 2015Lecture 12 min
Peut-on parler de pseudo-asthme cardiaque ?
S. LEROY*, P. MOCERI**, C. SANFIORENZO*/*Service de pneumologie, hôpital Pasteur, CHU de Nice/**Service de cardiologie, hôpital Pasteur, CHU de Nice
L’association insuffisance cardiaque gauche et sibilants définit « l’asthme cardiaque » ou le « pseudo-asthme cardiaque ». Il représente jusqu’à un tiers des formes cliniques des patients âgés. Si la constatation clinique est classique, les mécanismes physiopathologiques impliqués dans ce phénomène sont plus complexes. Les comorbidités respiratoires et l’impact favorable des traitements bronchodilatateurs participent à la confusion.
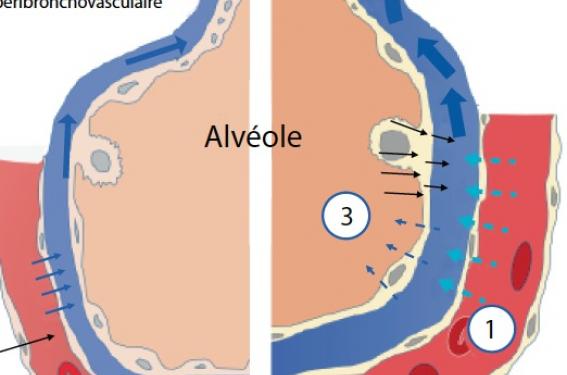
Les cliniciens décrivent lors de poussées d’insuffisance cardiaque gauche ou de formes apparentées la présence de sibilants expiratoires. Cette association définit « l’asthme cardiaque » ou le « pseudo-asthme cardiaque », ainsi dénommé par Hope, Osler et McKenzie en 1835(1). Il représente jusqu’à un tiers des formes cliniques des patients âgés. Si le tableau clinique est classique, la physiopathologie est plus obscure. Quels sont donc les principaux mécanismes en cause dans ce phénomène ? Quels types de patients sont concernés ? Quels examens complémentaires sont à pratiquer ? Quelles sont les conséquences sur les épreuves fonctionnelles respiratoires ? Quel est l’impact des thérapeutiques ? Figure 1. Physiopathologie de l’œdème pulmonaire cardiogénique. Mécanismes supposés de l'obstruction bronchique La compression péribronchique résulterait du fait que les voies aériennes se situent anatomiquement dans une gaine qui contient les branches de l’artère pulmonaire et les vaisseaux lymphatiques. L’augmentation initiale de la résistance des voies aériennes observée dans l’œdème pulmonaire serait secondaire à la distension des artères au sein de ces gaines peu extensibles et responsables d’une compression des petites voies aériennes (figure 2). Ce phénomène a été étudié chez des sujets sains après perfusion rapide de sérum physiologique. Une fermeture transitoire des petites voies aériennes sans impact sur les grosses voies a été observée(2). Une augmentation de l’épaisseur des parois bronchiques compatible avec l’œdème péribronchique et intraluminal entraîne une réduction de leur calibre(3). Les altérations fonctionnelles respiratoires sont compatibles avec ces constatations anatomiques. La bronchoconstriction serait causée via le réflexe vagal par l’activation des fibres amyéliniques C et des récepteurs J sensibles à l’étirement de l’espace interstitiel. Une hyperréactivité bronchique est ainsi montrée chez des patients porteurs d’une dysfonction ventriculaire gauche ou d’une valvulopathie mitrale(4). Chez l’animal, l’insuffisance cardiaque induit une stimulation adrénergique chronique qui diminue la relaxation des voies aériennes(5). Certaines malformations cardiovasculaires peuvent également expliquer l’obstruction bronchique par compression extrinsèque de l’axe trachéobronchique et/ou constitution d’une trachéo-bronchomalacie(6). Figure 2. Représentation des mécanismes physiopathologiques aboutissant à une obstruction des voies aériennes suite à une surcharge des artères et des veines pulmonaires. Quels types de patients sont concernés ? Les enfants porteurs d’anomalies cardiovasculaires L’incidence des malformations cardiovasculaires est estimée à 1 % des naissances. Parfois les signes tels qu’un wheezing, un stridor isolé ou une toux chronique sont les seuls symptômes révélateurs de cardiopathie congénitale(6). Le mode d’entrée dans la maladie peut mimer une bronchiolite ou de l’asthme(7). Les cardiopathies congénitales peuvent entraîner une obstruction bronchique secondaire à l’œdème pulmonaire d’une insuffisance cardiaque congestive, ou bien à des compressions trachéobronchiques selon 4 mécanismes : – la dilatation de l’artère pulmonaire et de ses branches, très fréquente dans les situations d’hyperdébit pulmonaire ; – la dilatation de l’oreillette gauche en dessous de la carène retrouvée en cas d’insuffisance ou de sténose mitrale ; – une cardiomégalie massive ; – ou une atteinte de la bronche souche gauche. Les malformations vasculaires (persistance des arcs aortiques, trajet aberrant de l’artère pulmonaire gauche, anomalies de l’artère innominée) engendrent essentiellement la compression de l’axe trachéo-bronchique et la trachéobronchomalacie. L’artère pulmonaire gauche à trajet aberrant est associée à des anomalies cardiaques congénitales dans 50 % des cas et à des malformations pulmonaires. Elle peut entraîner des compressions bronchiques extrinsèques intermittentes simulant un asthme. Il est donc important de penser aux malformations cardiovasculaires dans les formes d’asthmes « résistants au traitement ». Les patients souffrant d’une insuffisance cardiaque gauche La présentation clinique de l’insuffisance cardiaque gauche peut simuler une crise d’asthme par une toux et des sibilants. Ces crises « d’asthme cardiaque » sont le plus souvent nocturnes du fait d’une modification de la balance du système nerveux autonome au cours du sommeil paradoxal, de la position allongée qui favorise la fermeture des petites voies aériennes et induit l’augmentation de la pression veineuse pulmonaire. L’insuffisance cardiaque gauche peut entraîner des modifications structurales chroniques par remodelage, diminuer alors le calibre bronchique et perpétuer l’hyperréactivité bronchique(8). La réversibilité de l’obstruction bronchique par inhalation de bronchodilatateurs est controversée. Light et George ont montré qu’au cours de l’insuffisance cardiaque gauche la diminution des flux expiratoires était résolutive sous diurétiques et l’augmentation des résistances pulmonaires sous dérivés nitrés(9). Les patients atteints d’une valvulopathie mitrale Quatre-vingt pour cent des patients souffrant d’une sténose mitrale serrée ont présenté des signes d’obstruction bronchique sous forme de toux et de sibilants. La résistance des voies aériennes y est augmentée d’un facteur 4(10). L’augmentation des pressions vasculaires pulmonaires et lymphatiques favorisent l’œdème pulmonaire, bronchique et péribronchique. Cette congestion pulmonaire stimule les fibres C et les récepteurs J induisant la bronchoconstriction via l’activation vagale. Une HRB 5 fois plus importante a été montrée chez ces patients et serait corrélée à la sévérité de la sténose(11). Le remplacement valvulaire mitral ou la valvuloplastie mitrale percutanée amélioreraient ces paramètres. Dans le cadre d’une sténose mitrale chronique, les veines de la muqueuse bronchique sont distendues et engorgées par l’augmentation des débits anastomotiques broncho-pulmonaires. L’œdème pulmonaire chronique crée de la fibrose et participe au remodelage et à la diminution de calibre des voies aériennes, chronicisant le trouble ventilatoire obstructif. Les sujets âgés L’insuffisance cardiaque congestive du sujet âgé est la forme clinique du pseudo-asthme du sujet âgé. Elle serait présente chez 35 % des patients de plus de 65 ans atteints d’une insuffisance cardiaque congestive. Cette forme de pseudo-asthme est plus fréquemment retrouvée chez les fumeurs et les patients BPCO. Dans une étude sur 214 patients (82 ans de moyenne d’âge) présentant un tableau d’insuffisance cardiaque gauche, deux groupes étaient différenciés : « asthme cardiaque » et forme classique. À la prise en charge initiale, le groupe « asthme cardiaque » avait moins de crépitants et moins de cardiomégalie à la radiographie thoracique. En revanche, l’acidose respiratoire, la distension thoracique, l’obstruction des voies aériennes distales (baisse du VEMS et du DEM25-75) et l’utilisation de bronchodilatateurs étaient plus marquées. Aucune différence échographique, biologique (BNP et NT-proBNP) ou pronostic n’était pourtant retrouvée(12). La difficulté est souvent de différencier cette forme d’« asthme cardiaque » d’une exacerbation spastique de BPCO ou d’une vraie crise d’asthme. Pour cela, les antécédents personnels, le facteur déclenchant de la dyspnée « sifflante » et la réponse thérapeutique sont des outils intéressants. L’échographie cardiaque et les marqueurs biologiques (BNP et NT-pro BNP) sont également d’une aide diagnostique majeure. Les formes liées à l’altitude L’ascension rapide au-delà de 3 000 mètres peut causer le mal des montagnes, dont l’œdème pulmonaire d’altitude (OPA). Les symptômes sont une dyspnée associée à des râles bronchiques et des sibilants sans anomalie radiologique. La spirométrie confirme un trouble ventilatoire mixte à nette prédominance obstructive(13). La susceptibilité individuelle, le degré de préacclimatation, le dénivelé et l’altitude atteinte sont les quatre facteurs à considérer pour cette pathologie. Une réponse ventilatoire diminuée à l’hypoxie, associée à une réponse vasculaire pulmonaire exagérée est déterminante dans le développement de ce phénomène. Faut-il pratiquer des examens complémentaires en phase aiguë ? L’ensemble du tableau clinique incluant les antécédents du patient et les réponses thérapeutiques permet souvent de distinguer asthme et pseudo-asthme d’origine cardiaque. L’imagerie thoracique, l’échographie cardiaque et le dosage du peptide natriurétique de type B (BNP) ou NT-pro BNP sont des examens souvent indispensables. Un syndrome interstitiel ou alvéolointerstitiel en aile de papillon, des épanchements pleuraux bilatéraux, une cardiomégalie sont en faveur d’une décompensation cardiaque gauche. L’échographie cardiaque en évaluant la fonction ventriculaire gauche et les pressions de remplissage est un examen clé dans ce contexte. Le BNP est un polypeptide libéré par les myocytes ventriculaires en proportion directe de la tension pariétale cellulaire. Les concentrations circulantes de BNP et du fragment aminoterminal de sa prohormone (NT-pro BNP) sont augmentées dans l’insuffisance cardiaque congestive en proportion du degré de dysfonction ventriculaire gauche et des pressions de remplissage. Les valeurs seuils sont plus élevées dans les populations âgées, ainsi que chez les patients présentant une dysfonction rénale. Chez les patients dyspnéiques sans hypertrophie ventriculaire gauche, le BNP pourrait différencier une maladie pulmonaire obstructive de l’insuffisance cardiaque diastolique de façon plus discriminante que les données échocardiographiques(14). L’utilisation du dosage plasmatique du BNP en pratique courante a donc aidé la gestion d’urgence des dyspnées aiguës sifflantes. Toutefois, son augmentation n’est pas spécifique de l’insuffisance cardiaque, elle est influencée par l’ischémie myocardique, les troubles du rythme, les sepsis et états de choc, l’anémie, l’insuffisance rénale, l’hypoxie, l’embolie pulmonaire aiguë, l’hypertension pulmonaire et le syndrome de détresse respiratoire aiguë. Cependant, un seuil de BNP > 400 ng/ml rend le diagnostic d’insuffisance cardiaque très probable en présence d’une dyspnée. De nouveaux marqueurs sont en cours d’évaluation, notamment ceux qui détectent la région moyenne de prohormones (proadrénomédulline [MR-proADM] et du pro-peptide natriurétique auriculaire [MR-proANP]), afin de pallier aux limites du BNP dans la zone grise entre 100 et 400 ng/ml(15). Cette stratégie pourrait donc participer à la distinction entre asthme et pseudo-asthme, au prix d’un surcoût envisageable dans les situations où la clinique n’est pas discriminante. Les épreuves fonctionnelles respiratoires sont-elles perturbées en cas de pseudo-asthmes cardiaques ? La fonction respiratoire de repos La simple variation de diurèse influence le contenu en eau du poumon et modifie la fonction respiratoire. La perfusion rapide de sérum salé entraîne une diminution asymptomatique de la capacité vitale et de la capacité pulmonaire totale. Certains auteurs rapportent une baisse significative de 14 % de la CVF, de 16 % du VEMS, de 15 % du DEM25/75, de 19 % du DEP, de 6 % de la CPT et une augmentation de 38 % du volume résiduel sans impact sur le rapport VEMS/CV(16). La même expérience chez des sujets non fumeurs porteurs d’une dysfonction ventriculaire gauche asymptomatique provoque également une obstruction bronchique et une baisse de la capacité de diffusion alvéolo-capillaire du CO par l’altération exclusive de la diffusion membranaire. À noter que la capnographie et la mesure du NO exhalé n’ont pas à ce jour leur place pour distinguer cause cardiaque et respiratoire. L’hyperréactivité bronchique non spécifique Il y a plus de 20 ans que l’hyperréactivité bronchique non spécifique (HRB) a été décrite chez les patients atteints d’insuffisance cardiaque gauche en phase aiguë et chronique. L’origine de cette insuffisance cardiaque ne semble pas influencer la présence ou non d’une HRB, puisqu’elle est décrite pour les cardiopathies ischémiques, les cardiomyopathies dilatées et les valvulopathies mitrales. Le degré d’HRB n’apparaît pas toujours corrélé aux altérations hémodynamiques, ni à la fonction respiratoire de repos. Sous traitement cardiaque, cette HRB ne disparaît pas toujours et suggère que l’insuffisance cardiaque induit des remaniements spécifiques des voies aériennes plus complexes que la simple infiltration œdémateuse. L’HRB constatée avant valvuloplastie persiste chez près de la moitié des patients après chirurgie valvulaire(17). La limite de ces études réside dans l’intrication du tabagisme des patients concernés par ces pathologies. Les bronchodilatateurs ont-ils un effet en cas de décompensation cardiaque gauche aiguë ? Il y a peu de données concernant l’impact des traitements bronchodilatateurs sur la fonction respiratoire des patients insuffisants cardiaques. Une étude sur l’ipratropium bromure confirmait un effet bronchodilatateur avec un effet supérieur en phase d’œdème aigu pulmonaire (+ 286 ml de VEMS en moyenne) comparé à l’état basal (+ 111 ml de VEMS)(18). Ceci soutiendrait l’hypothèse d’une majoration du tonus vagal bronchique lors de l’œdème pulmonaire. Les bêta2-mimétiques ont également été proposés dans la prévention de l’œdème pulmonaire d’altitude (OPA) chez des sujets prédisposés. Ainsi, le salmétérol réduirait de 50 % ce risque d’OPA(19). Plusieurs mécanismes contribueraient à ce résultat : l’amélioration de la clairance des fluides alvéolaires par stimulation du transport sodique transépithélial, l’augmentation de la ventilation alvéolaire et l’atténuation de l’hypoxie favoriseraient aussi la réabsorption du sodium et des liquides alvéolaire, et diminuerait les effets de l’hypoxie sur la microcirculation pulmonaire. Dans l’insuffisance cardiaque gauche en état stable, une étude spirométrique à l’effort n’a pas observé de bronchoconstriction. Le prétraitement par bronchodilatateurs de type albutérol ou ipratropium bromide n’a pas modifié les données spirométriques, le niveau de ventilation, ni la saturation en oxygène au cours de l’effort et en récupération. Les performances à l’exercice étaient donc comparables au placebo(20).
Attention, pour des raisons réglementaires ce site est réservé aux professionnels de santé.
pour voir la suite, inscrivez-vous gratuitement.
Si vous êtes déjà inscrit,
connectez vous :
Si vous n'êtes pas encore inscrit au site,
inscrivez-vous gratuitement :





